M
You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
B
binbon249
Bài tập.
1) Cho a (mol) [TEX]CO_2[/TEX] tác dụng vs dd NaOH chưa b (mol) NaOH. Biện luận các trường hợp xảy ra. Tính khối lượng sản phẩm.
Gọi x, y lần lược là số mol của [TEX]CO_2[/TEX] tham gia phản ứng trong 2 phương trình:
Vì [TEX]NaOH[/TEX] dư, nên tính theo số mol của [TEX]CO_2=a[/TEX]
Vì [TEX]CO_2[/TEX] dư nên tính theo NaOH=b mol
2) Cho a (mol) [TEX]CO_2[/TEX] tác dụng vs dd [TEX]Ca(OH)_2[/TEX] chưa b (mol) NaOH. Biện luận các trường hợp xảy ra. Tính khối lượng sản phẩm.
~> giải thích rõ ràng giùm ạ.
-Gọi x, y lần lược là sô mol của [TEX]CO_2[/TEX] tham gia phản ứng trong 2 pt trên:
Vì [TEX]Ca(OH)_2[/TEX] dư nên tính theo [TEX]CO_2=a[/TEX]
Vì [TEX]CO_2[/TEX] dư nên tính theo [TEX]Ca(OH)_2[/TEX]
0
0915549009
1) Xác định lượng NaCl kết tinh trở lại khi làm lạnh 548 gam dung dịch muối ăn bão hoà ở [TEX]50^o[/TEX] xuống [TEX]0^o[/TEX]. Biết độ tan của NaCl ở [TEX]50^o[/TEX] là 37 gam và ở [TEX]0^o[/TEX] là 35 gam.
2) Hoà tan 450g [TEX]KNO_3[/TEX] vào 500g nước cất ở [TEX]250^o[/TEX](dung dịch X). Biết độ tan của KNO3 ở [TEX]20^o[/TEX] là 32g. Hãy xác định khối lượng [TEX]KNO_3[/TEX] tách ra khỏi dung dịch khi làm lạnh dung dịch X đến [TEX]20^o[/TEX].
Bài trên tớ làm đc rùi, chỉ cần bài sau thui
2) Hoà tan 450g [TEX]KNO_3[/TEX] vào 500g nước cất ở [TEX]250^o[/TEX](dung dịch X). Biết độ tan của KNO3 ở [TEX]20^o[/TEX] là 32g. Hãy xác định khối lượng [TEX]KNO_3[/TEX] tách ra khỏi dung dịch khi làm lạnh dung dịch X đến [TEX]20^o[/TEX].
Bài trên tớ làm đc rùi, chỉ cần bài sau thui
Last edited by a moderator:
B
babyheo16397
cho em hỏi bài hoá này:1) " Với 300 gam NaCl có thể pha được bn ml dd NaCl 10% có D = 1.017 g/ml "
2)"Cần bn gam SO3 hoà tan vào dd H2SO4 50% để điều chế 100 gam dd H2SO4 79% "
2)"Cần bn gam SO3 hoà tan vào dd H2SO4 50% để điều chế 100 gam dd H2SO4 79% "
H
hokthoi
1/áp dụng CT C%=(mct*100)/mdd =>mdd
áp dụng CT: D=m/V=>V
2/tương tự bài 1
bạn nên search trên gool hoặc các công cụ tìm kiếm khác trước khi đăng bài vì các bài toán như trên đã có trên diễn đàn và được giải thích rất cụ thể
Chúc bạn học tốt!
áp dụng CT: D=m/V=>V
2/tương tự bài 1
bạn nên search trên gool hoặc các công cụ tìm kiếm khác trước khi đăng bài vì các bài toán như trên đã có trên diễn đàn và được giải thích rất cụ thể
Chúc bạn học tốt!
K
k.nguyen.73
Mod xem lại nhé
: Tạo ra hai muối

Gọi x, y lần lược là số mol của [TEX]CO_2[/TEX] tham gia phản ứng trong 2 phương trình:
\\%20&m_{Na_2CO_3}=106(b-a)%20\end{cases}})
Tạo muối [TEX]Na_2CO_3[/TEX]

Vì [TEX]NaOH[/TEX] dư, nên tính theo số mol của [TEX]CO_2=a[/TEX]

Tạo muối [TEX]NaHCO_3[/TEX]

Vì [TEX]CO_2[/TEX] dư nên tính theo NaOH=b mol

Tạo hai muối
_2%20\rightarrow%20CaCO_3%20\downarrow%20+%20H_2O}\\%20{\color{Blue}%202CO_2%20+%20Ca(OH)_2%20\rightarrow%20Ca(HCO_3)_2})
-Gọi x, y lần lược là sô mol của [TEX]CO_2[/TEX] tham gia phản ứng trong 2 pt trên:
\\%20&%20m_{CaHCO_3}=101(a-b)%20\end{cases}})
Tạo muối [TEX]CaCO_3[/TEX]
_2%20\rightarrow%20CaCO_3%20\downarrow%20+%20H_2O})
Vì [TEX]Ca(OH)_2[/TEX] dư nên tính theo [TEX]CO_2=a[/TEX]

Tạo muối [TEX]Ca(HCO_3)_2[/TEX]
Vì [TEX]CO_2[/TEX] dư nên tính theo [TEX]Ca(OH)_2[/TEX]

5 TH ở đây là:
+ a = b
+ 2a = b
+ 1 < b/a< 2
+ [TEX]CO_2 [/TEX] dư
+ NaOH dư
~> giải thích rõ ràng giùm mod nhấ, mà chưa học giải hệ phương trình, mod làm đơn giản giùm
Thân!
N
nguyenthuhuong0808
1) Cho a (mol) [TEX]CO_2[/TEX] tác dụng vs dd NaOH chứa b (mol) NaOH. Biện luận các trường hợp xảy ra. Tính khối lượng sản phẩm.
2 NaOH + CO2 -> Na2CO3 + H2O (1)
NaOH + CO2 -> NaHCO3 (2)
*/ với b \geq a thì [TEX]\frac{n_{NaOH}}{n_{CO2}} = \frac{b}{a}[/TEX]\leq 1
=> chỉ xảy ra pu 1 tạo muối trung hòa Na2CO3 và NaOH pu hết
n Na2Co3 = n NaOH = b mol
=> m Na2CO3 = 106b g
m Co2(nếu có) = 44(a -b) g
*/ với a\leq b \leq 2a => 1 \leq [TEX]\frac{n_{NaOH}}{n_{CO2}} = \frac{b}{a}[/TEX] \leq 2
=> xảy ra cả pu 1 và 2
Đặt n NaOH (1) = x
n NaOH (2)= y
=> x + y = b
0,5x + y =a
giải ra x = 2(b -a)
y = 2a -b
=> m Na2Co3 và m NaHCO3
*/ nếu b\geq 2a thì [TEX]\frac{n_{NaOH}}{n_{CO2}} = \frac{b}{a}[/TEX] \geq 2
=> chỉ xảy ra pu 2 tạo muối axit
.... (tự giải tiếp)
bài 2 tương tự
3 trường hợp là làm gộp...
đầy đủ là 5
cũng chẳng cần thiết phải là 5
lương dư ghi nếu có là được rồi
Last edited by a moderator:
B
binbon249
Xác định lượng NaCl kết tinh trở lại khi làm lạnh 548 gam dung dịch muối ăn bão hoà ở [TEX]50^o[/TEX] xuống [TEX]0^o[/TEX]. Biết độ tan của NaCl ở [TEX]50^o[/TEX] là 37 gam và ở [TEX]0^o[/TEX] là 35 gam.
Bạn giải thik rõ ràng cách làm cho tớ, tớ ngu hóa lắm ^^
*Bài này có 3 cách*
*Cách 1*
Vậy trong 548gam dung dịch NaCl bão hòa sẽ có x gam NaCl
tỉ lệ:
100+37-------->37
548------------->x
từ đó suy ra x=148 gam;
- Ở 0*C
100 gam nước hòa tan 35 gam NaCl (theo định nghĩa độ tan của một chất)
400 gam nước hòa tan y gam NaCl
suy ra y=140 g, suy ra khối lượng NaCl kết tinh trở lại =148-140=8(g)
(tức khối lương NaCl có trong dung dịch bão hòa ở 50*C trừ cho khối lượng NaCl tan trong 400 gam nước)
*Cách 2*
- Gọi x là khối lượng NaCl có trong 548g dung dịch bão hòa, vậy khối lượng nước sẽ là 548-x (vì trong dung dịch NaCl có chứa NaCl và nước, khối lượng của NaCl là x, thì khối lượng của nước sẽ là (548-x )- Trong 100 gam nước hòa tan 37gam, vậy trong (548-x)g hòa tan x gam
suy ra x=148g
rồi gải như C1
*Cách 3*
Khi làm lạnh 137g dung dịch bão hòa (50*C-->0*C) thì khối lượng dung dịch giảm 37-35=2(g). [2g kết tinh]137g dung dịch NaCl (50*C-->0*C) có 2 gam kết tinh
548 g dung dịch NaCl (50*C-->0*C) có x gam kết tinh
suy ra x=8
= KL=
Những bài tập như thế này thường chúng ta giải theo cách lập tỉ lệ tương ứng rồi tính Bạn có thể làm thử bài này: Hỏi có bao nhiêu gam NaCl kết tinh khi làm lạnh 600 gam dung dịch NaCl bão hòa ở 90*C xuống 0*C. Biết độ tan của NaCl ở 90*C là 50 gam và ở 0*C là 35g
Đáp số của bài này là 140 gam, cách làm tương tự
========================================================
Bạn xem có chỗ nào chưa hiểu thì hỏi lại mình nha
===========================================
2) Hoà tan 450g [TEX]KNO_3[/TEX] vào 500g nước cất ở [TEX]250^o[/TEX](dung dịch X). Biết độ tan của KNO3 ở [TEX]20^o[/TEX] là 32g. Hãy xác định khối lượng [TEX]KNO_3[/TEX] tách ra khỏi dung dịch khi làm lạnh dung dịch X đến [TEX]20^o[/TEX].
Bài trên tớ làm đc rùi, chỉ cần bài sau thui
Bài này bạn giải tương tự bài ở trên , xem chi tiết ở phía dưới
Last edited by a moderator:
0
02615948
2) Hoà tan 450g [TEX]KNO_3[/TEX] vào 500g nước cất ở [TEX]250^o[/TEX](dung dịch X). Biết độ tan của KNO3 ở [TEX]20^o[/TEX] là 32g. Hãy xác định khối lượng [TEX]KNO_3[/TEX] tách ra khỏi dung dịch khi làm lạnh dung dịch X đến [TEX]20^o[/TEX].
Bài trên tớ làm đc rùi, chỉ cần bài sau thui
Ở nhiệt độ [TEX]20^oC[/TEX] ta có:
100g nước hòa tan được 32g [TEX]KNO_3[/TEX] tạo thành dung dịch [TEX]KNO_3[/TEX] bão hòa
500g nước hòa tan được Yg [TEX]KNO_3[/TEX] tạo thành dung dịch [TEX]KNO_3[/TEX] bão hòa
-->Y=160
Vậy khối lượng [TEX]KNO_3[/TEX] tách ra khỏi dung dịch khi làm lạnh dung dịch X đến [TEX]20^oC[/TEX] bằng: 450-160=290g
Thấy trong tin nhắn binbon nên vào xem sao
B
binbon249
Mod xem lại nhé
5 TH ở đây là:
+ a = b
+ 2a = b
+ 1 < b/a< 2
+ [TEX]CO_2 [/TEX] dư
+ NaOH dư
~> giải thích rõ ràng giùm mod nhấ, mà chưa học giải hệ phương trình, mod làm đơn giản giùm
Thân!
----> NaOH dư
P/S: đâu cần 5 trường hợp :|
B
binbon249
cho em hỏi bài hoá này:1) " Với 300 gam NaCl có thể pha được bn ml dd NaCl 10% có D = 1.017 g/ml "
2)"Cần bn gam SO3 hoà tan vào dd H2SO4 50% để điều chế 100 gam dd H2SO4 79% "
1) Phân tích bài toán:
+ Các dữ kiện đã cho:
từ (1)(2) ta có thể tìm được khối lượng dung dịch NaCl
- áp dụng công thức :
================================================
2) Bài này tương tự bài trước bạn hỏi tớ mà
áp dụng sơ đồ đường chéo nhé:
- -> C% H2SO4= 122,5%
Bài hóa được giải quyết xong
Mà mình giải hơi ngắn gọn thì phải, vì ở trang 1 cũng có 1 bài của bạn tương tự như thế này mà mình đã giải thích . Nên bạn có thể xem lại, kết hợp với tập tin đính kèm đó
Cố lên !!!
T
tulinh32
chị ơi nếu trong một PTHH chỉ cho biết số mol của một chất tham gia phản ứng còn chất còn lại thì không cho số mol và đề bài ghi đây là phản ứng hoàn toàn thì làm sao để nhận biết một trong hai chất tham gia phản ứng chất nào dư , mong chị giúp đỡ
B
binbon249
chị ơi nếu trong một PTHH chỉ cho biết số mol của một chất tham gia phản ứng còn chất còn lại thì không cho số mol và đề bài ghi đây là phản ứng hoàn toàn thì làm sao để nhận biết một trong hai chất tham gia phản ứng chất nào dư , mong chị giúp đỡ
Gỉa sử cho A pu với B thì
-khi một bài hóa nào đó bảo là phản ứng xảy ra hoàn toàn thì
TH1 : A hết và B hết
TH2 : A còn và B hết
TH3 : A hết và B còn
======================
Bạn có thẻ post một bài tập minh họa ko
Last edited by a moderator:
C
congchuarungxanh_hg
chị thông cảm vì hơi nhiều do em bị mất gốc ma nhờ chị nhác lại dể em áp dụng lam bài tập.thanks chị nhiều lắm
H
hokthoi
-Công thức tính số mol: n=m/M
m:khối lượng chất tính bằng gam
M :khối lượng mol của chất đơn vị là đvc
nếu trong 1 thể tích không đổi có hỗn hợp các chất thì số mol tỉ lệ thuận với thể tích
-Công thức tính nồng độ %
C%=(m(chất tan)*100)/m(dung dịch)
m tính bằng gam
m chất tan là khối lượng chất có độ tinh khiết là 100%
m dung dịch là khối lượng chất tan trên+ mH2O
-công thức tính nồng độ mol
[TEX]C_M[/TEX]=n/V (mol/lit)
v đơn vị là lít
-tỉ khối khí A so với khí B
d(A/B)=MA/MB
tĩ khối của khí A so với không khí
d(A/kk)=MA/29
-M trung bình của 2 chất A và B
[TEX]M_AB[/TEX]=(a+b)/(MA+MB)=(VA+VB)/(MA+MB)
nó có thể áp dụng cho n chất
M=(a+b+......)/(MA+MB+......)
-việc nhớ CT giữa C% và CM s rất khó nên anh đưa ra cách này
C%=([TEX]m_ct[/TEX]*100)/[TEX]m_dd[/TEX]
[TEX]C_M[/TEX]=n/v
v=[TEX]m_dd[/TEX]
[TEX]m_dd[/TEX]=([TEX]m_ct[/TEX]*100)/C%
[TEX]m_ct[/TEX]=n*M
=>[TEX]C_M[/TEX]=[TEX]\frac{n}{n*M*100}[/TEX]=[TEX]\frac{C%}{M*100}[/TEX]
m:khối lượng chất tính bằng gam
M :khối lượng mol của chất đơn vị là đvc
nếu trong 1 thể tích không đổi có hỗn hợp các chất thì số mol tỉ lệ thuận với thể tích
-Công thức tính nồng độ %
C%=(m(chất tan)*100)/m(dung dịch)
m tính bằng gam
m chất tan là khối lượng chất có độ tinh khiết là 100%
m dung dịch là khối lượng chất tan trên+ mH2O
-công thức tính nồng độ mol
[TEX]C_M[/TEX]=n/V (mol/lit)
v đơn vị là lít
-tỉ khối khí A so với khí B
d(A/B)=MA/MB
tĩ khối của khí A so với không khí
d(A/kk)=MA/29
-M trung bình của 2 chất A và B
[TEX]M_AB[/TEX]=(a+b)/(MA+MB)=(VA+VB)/(MA+MB)
nó có thể áp dụng cho n chất
M=(a+b+......)/(MA+MB+......)
-việc nhớ CT giữa C% và CM s rất khó nên anh đưa ra cách này
C%=([TEX]m_ct[/TEX]*100)/[TEX]m_dd[/TEX]
[TEX]C_M[/TEX]=n/v
v=[TEX]m_dd[/TEX]
[TEX]m_dd[/TEX]=([TEX]m_ct[/TEX]*100)/C%
[TEX]m_ct[/TEX]=n*M
=>[TEX]C_M[/TEX]=[TEX]\frac{n}{n*M*100}[/TEX]=[TEX]\frac{C%}{M*100}[/TEX]
Last edited by a moderator:
M
minhtuyenhttv
chị ơi nếu trong một PTHH chỉ cho biết số mol của một chất tham gia phản ứng còn chất còn lại thì không cho số mol và đề bài ghi đây là phản ứng hoàn toàn thì làm sao để nhận biết một trong hai chất tham gia phản ứng chất nào dư , mong chị giúp đỡ
:-j nhìn cái phần tô đỏ nhé, câu reply của binbon nó đối nhau quá xáGỉa sử cho A pu với B thì
-khi một bài hóa nào đó bảo là phản ứng xảy ra hoàn toàn thì
TH1 : A hết và B hết
TH2 : A còn và B còn
TH3 : A hết và B còn
======================
Bạn có thẻ post một bài tập minh họa ko
binbon249 said:Mình gõ nhầm, TH2 là A còn B hết nhưng vẫn 3 trường hợp chứ ko phải 2 trường hợp
Last edited by a moderator:
B
binbon249
[Box hóa THCS]Các công thức tính toán hóa học
Đơn vị cacbon:
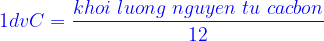
- Số avôgađrô:
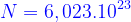
- Công thức tính khối lượng mol, số mol, khối lượng, thể tích:
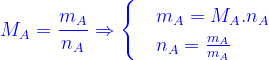
+ĐKTC:
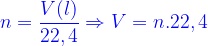
Tỉ khối hơi (d) của chất A đối với chất B(đo cùng điều kiện V,T,P)
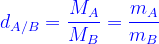
- Khối lượng riêng D:
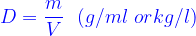
~~~~~~> lưu ý m ở đây là khối lượng của dung dịch<~~~~~~~
==========================================================
- đối với toán hh ta có các công thức sau:
1/ Đối với chất khí ( hỗn hợp 2 khí)
- KhốI lượng mol trung bình của 1 lít hõn hợp khí ở đktc:
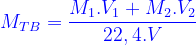
- Khối lượng trung bình của 1 mol hỗn hợp khí ở đktc :
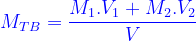
Hoặc:
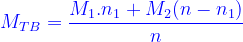 (n là tổng số mol khí trong hh)
(n là tổng số mol khí trong hh)
Hoặc:
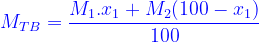 (x là % của khí thứ nhất)
(x là % của khí thứ nhất)
Hoặc:
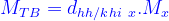
2. Đối với chất lỏng:
MTB của hh luôn nằm trong khoảng khối lượng mol phân tử của các chất thành phần trong hỗn hợp :
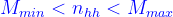
- Hỗn hợp 2 chất A, B có
 và có thành phần % theo số mol là a% và b%, khoảng xác định số mol của hh là:
và có thành phần % theo số mol là a% và b%, khoảng xác định số mol của hh là:

3. Khối lượng mol trung bình của một hỗn hợp
KL mol trung bình của một hh là khối lượng của 1 mol hh đó:
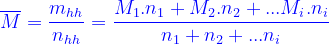 (*)
(*)
Trong đó:
+ [TEX]m_{hh}[/TEX] là số gam của hh
+ [TEX]n_{hh}[/TEX] là tổng số mol của hh
+ [TEX]M_1,M_2,..M_i[/TEX] là khối lượng mol của các chất trong hỗn hợp.
+ [TEX]n_1, n_2, ...n_i[/TEX] là số mol tương ứng của các chất
Tính chất:
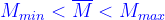
Đối với chất khí vì tỉ lệ với số mol nên (*) được viết lại thành:
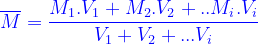 (**)
(**)
Từ (*)(**) ta suy ra:
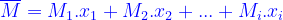 (***)
(***)
Trong đó,[TEX] x_1,x_2,...x_i[/TEX] là thành phần % số mol hoặc thể tích (nếu hh khí) tương ứng của các chất và được lấy theo số thập phân, nghĩa là 100% tương ứng với x=1, 50% tương ứng với x=0,5
Chú ý: Nếu hh chỉ gồm có hai chất có khối lượng mol tương ứng M1 và M2 thì các công thức (*)(**) và (***) được viết dưới dạng
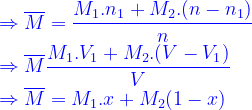
Trong đó [TEX]n_1,V_1,x[/TEX] là số mol, thể tích , thành phần % về sốm ol hoặc thể tích (hh khí) của chất thứ nhất M1. ta thường chọn M1>M2
Nhận xét: Nếu số mol ( hoặc thể tích ) hai chất bằng nhau thì :
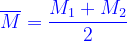
=====================================================================
Công thức tính chương độ tan, nồng độ dung dịch:
- Công thức tính độ tan:
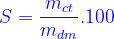
- Công thức tính nồng độ phần trăm:
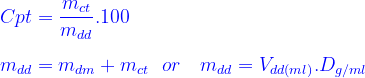
* Mối liên hệ giữa độ tan của một chất và nồng độ phần trăm dung dịch bão hòa của chất đó ở một nhiệt độ xác định:
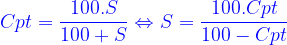
Công thức tính nồng độ mol/l :
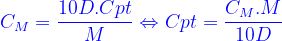
Trong đó:
+ [TEX]m_{ct}[/TEX]: là khối lượng chất tan (đv: gam)
+[TEX]m_{dm}[/TEX]: là khối lượng dung môi (đv: gam)
+[TEX]m_{dm}[/TEX]: là khố lượng dung dịch (đv: gam)
+V là thể tích dung dịch ( đơn vị : lít hoặc ml)
+D là khối lượng riêng của dung dịch (đv: g/ml)
+M là khối lượng mol của chất (đv: gam)
+ S là độ tan của một chất ở nhiệt độ xác định (đv:g)
+ Cpt nồng độ phần trăm của 1 chất trong dung dịch (đv: %)
+ [TEX]C_M[/TEX] là nồng độ mol/l của 1 chất trong dung dịch (đv:
mol/l hay M)
Đơn vị cacbon:
- Số avôgađrô:
- Công thức tính khối lượng mol, số mol, khối lượng, thể tích:
+ĐKTC:
Tỉ khối hơi (d) của chất A đối với chất B(đo cùng điều kiện V,T,P)
- Khối lượng riêng D:
~~~~~~> lưu ý m ở đây là khối lượng của dung dịch<~~~~~~~
==========================================================
- đối với toán hh ta có các công thức sau:
1/ Đối với chất khí ( hỗn hợp 2 khí)
- KhốI lượng mol trung bình của 1 lít hõn hợp khí ở đktc:
- Khối lượng trung bình của 1 mol hỗn hợp khí ở đktc :
Hoặc:
Hoặc:
Hoặc:
2. Đối với chất lỏng:
MTB của hh luôn nằm trong khoảng khối lượng mol phân tử của các chất thành phần trong hỗn hợp :
- Hỗn hợp 2 chất A, B có
3. Khối lượng mol trung bình của một hỗn hợp
KL mol trung bình của một hh là khối lượng của 1 mol hh đó:
Trong đó:
+ [TEX]m_{hh}[/TEX] là số gam của hh
+ [TEX]n_{hh}[/TEX] là tổng số mol của hh
+ [TEX]M_1,M_2,..M_i[/TEX] là khối lượng mol của các chất trong hỗn hợp.
+ [TEX]n_1, n_2, ...n_i[/TEX] là số mol tương ứng của các chất
Tính chất:
Đối với chất khí vì tỉ lệ với số mol nên (*) được viết lại thành:
Từ (*)(**) ta suy ra:
Trong đó,[TEX] x_1,x_2,...x_i[/TEX] là thành phần % số mol hoặc thể tích (nếu hh khí) tương ứng của các chất và được lấy theo số thập phân, nghĩa là 100% tương ứng với x=1, 50% tương ứng với x=0,5
Chú ý: Nếu hh chỉ gồm có hai chất có khối lượng mol tương ứng M1 và M2 thì các công thức (*)(**) và (***) được viết dưới dạng
Trong đó [TEX]n_1,V_1,x[/TEX] là số mol, thể tích , thành phần % về sốm ol hoặc thể tích (hh khí) của chất thứ nhất M1. ta thường chọn M1>M2
Nhận xét: Nếu số mol ( hoặc thể tích ) hai chất bằng nhau thì :
=====================================================================
Công thức tính chương độ tan, nồng độ dung dịch:
- Công thức tính độ tan:
- Công thức tính nồng độ phần trăm:
* Mối liên hệ giữa độ tan của một chất và nồng độ phần trăm dung dịch bão hòa của chất đó ở một nhiệt độ xác định:
Công thức tính nồng độ mol/l :
Trong đó:
+ [TEX]m_{ct}[/TEX]: là khối lượng chất tan (đv: gam)
+[TEX]m_{dm}[/TEX]: là khối lượng dung môi (đv: gam)
+[TEX]m_{dm}[/TEX]: là khố lượng dung dịch (đv: gam)
+V là thể tích dung dịch ( đơn vị : lít hoặc ml)
+D là khối lượng riêng của dung dịch (đv: g/ml)
+M là khối lượng mol của chất (đv: gam)
+ S là độ tan của một chất ở nhiệt độ xác định (đv:g)
+ Cpt nồng độ phần trăm của 1 chất trong dung dịch (đv: %)
+ [TEX]C_M[/TEX] là nồng độ mol/l của 1 chất trong dung dịch (đv:
mol/l hay M)
B
binbon249
Đối với những bài tập như thế này thì chúng ta sẽ phải biện luận, có thể bài toán sẽ cho hh 2 chất tác dụng với nhau vì vậy mình sẽ đưa cho bạn cách biện luận theo 2 hh tác dụng với nhau, 2 chất td với nhau hoàn toàn tương tựchị ơi nếu trong một PTHH chỉ cho biết số mol của một chất tham gia phản ứng còn chất còn lại thì không cho số mol và đề bài ghi đây là phản ứng hoàn toàn thì làm sao để nhận biết một trong hai chất tham gia phản ứng chất nào dư , mong chị giúp đỡ
=========================================================
- Với bài toán hai chất A,B chư biết số mol cùng tác dụng với a hoặc hai chất X,Y đã biết số mol . để biết sau phản ứng đã hết A, B hay X, Y chưa. Có thể giả thiết hh A, B chỉ chứa 1 chất A hoặc B
- Với
Như vậy nếu X, Y tác dụng với A mà còn dư, thì X,Y sẽ có dư để tác dụng hết với hh A, B
- Với
Vậy nếu X, Y tác dụng chưa đủ với B thì cũng ko đủ để tác dụng với hh A, B. Nghĩa là sau pu X,Y hết còn A,B dư
C
chemistry1713
Các bạn thử làm bài này xem
Nguyên tử khối của kim loại R lớn hơn nguyên tử khối của kim loại M là 1 đvc với x; y là số mol M và R, có hệ phương trình sau:
[TEX]\left{\begin{(2M+96)x + (R+96)y = 3,82}\\{x + y = 0,03}\\ { R = M+1 } [/TEX]
Nguyên tử khối của kim loại R lớn hơn nguyên tử khối của kim loại M là 1 đvc với x; y là số mol M và R, có hệ phương trình sau:
[TEX]\left{\begin{(2M+96)x + (R+96)y = 3,82}\\{x + y = 0,03}\\ { R = M+1 } [/TEX]
binbon249 said:Post đề bài lên đi bạn ơi...
Last edited by a moderator:
D
dethuongqua
Đây chắc là tìm R; MCác bạn thử làm bài này xem
Nguyên tử khối của kim loại R lớn hơn nguyên tử khối của kim loại M là 1 đvc với x; y là số mol M và R, có hệ phương trình sau:
[TEX]\left{\begin{(2M+96)x + (R+96)y = 3,82}\\{x + y = 0,03}\\ { R = M+1 } [/TEX]
theo mình giải theo pt nghiệm nguyên ấy
[TEX] x+y=0,03 \Rightarrow 0<x<0,03[/TEX]
_ Giả sử [TEX] x=0,03 ; y=0[/TEX]
\Rightarrow [TEX] (2M+96)0,03 + (M+97).0 > 3,82 \Rightarrow 0,06M > 0,94 [/TEX]
\Rightarrow [TEX] M >15,67 [/TEX]
_[TEX] 0<y<0,03 [/TEX] Giả sử [TEX] x=0; y = 0,03 [/TEX]
Giải tương tự được
[TEX] M < 30,33[/TEX]
Kết hợp được [TEX] 15,67 < M < 30,33 [/TEX]
Biện luận:trong khoảng đó, ta chọn được M là Na hoặc Mg
Nếu M là Mg \Rightarrow R = 25 (loại), M là Na \Rightarrow R = Mg
Last edited by a moderator:

