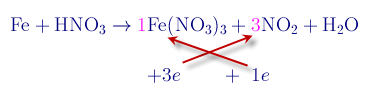II : Bài Tập Áp Dụng
Bài 2 : cho 140,4 g Al td với dung dịch [TEX]HNO_3[/TEX] loãng dư được hh X gồm [TEX](NO; N_2;N_2O)[/TEX] tỷ lệ 1:2:2 về số mol giá trị [TEX]V_x[/TEX] là:
A 44,8 (l)
B 22,4 (l)
C 56 (l)
D 33,6 (l)
$n_{Al^{3+}} = 5,2 mol$
$Al ---^{-3e}--> Al^{3+} $
5,2.......15,6
$N^{+5} --^{+3e}--> N^{+2}$
....................3x..............x
$4N^{+5} --^{+20e}--> 2N_2^{+2}$
........................20x.............2x
$4N^{+5} --^{+16e}--> 2N_2^{-1}$
........................16x.............2x
bảo toàn e : $25,6x = 39x => x = 0,4 => V = 44,8l$
Bài 3 : (đề thi đại học khối A : 2009) Hoà tan 3,024 KL M trong [TEX]HNO_3 [/TEX] dư thu được 940,8 mml khí [TEX]N_xO_y[/TEX] có tỷ khối hơi so với [TEX]H_2[/TEX] là 22 là (spkdn) ở (đktc). Khí [TEX]N_xO_y[/TEX] và KL M là :
A NO và Mg
B [TEX]N_2O[/TEX] và Al
C [TEX]N_2O[/TEX] và Fe
D [TEX]NO_2[/TEX] và Al
tỉ khối so với H2 là 44 => khí là $N_2O$
$n_{N_2O} = 0,042 mol$
$M --^{-ne}-> M^{+n}$
$\frac{3,024}{M}.....\frac{3,024n}{M}$
$N^{+5} --^{+8e}---> N_2^{-1}$
0,042.............0,336
bảo toàn e : $\frac{3,024n}{M} = 0,336$
với n = 3 => M = 27 => Al => đáp án B
Bài 4 :(đề thi đại học khối A : 2009)
Hoà tan hoàn toàn 12,42 g Al trong dung dịch [TEX]HNO_3 [/TEX] loãng dư sau phản ứng thu đuợc hỗn hợp khí X gồm có [TEX]N_2; N_2O [/TEX] có thể tích là 1,34 (l). có tỉ khối hơi so với [TEX]H_2 =18 [/TEX]cô cạn dung dịch sau phản ứng thu được m g muối khan . m?
A 34,08 g
B 106,38
C 38,34
D 97,98
áp dụng pp đường chéo :
$n_{N_2} = n_{N_2O} = 0,03 mol $
$Al ---^{-3e}--> Al^{3+} $
0,46......1,38
$2N^{+5} --^{+10e}--> N_2^{+2}$
0,03.................0,3
$2N^{+5} --^{+8e}--> N_2^{-1}$
0,03.................0,24
e nhường hơn e nhận => tạo muối $NH_4NO_3$
bảo toàn e :$ 1,38 = 0,54 + 8n_{NH_4NO_3}$
$=> n_{NH_4NO_3} = 0,105 mol$
m muối = 0,46.213 + 0,105.80 = 106,38 gam => B
Bài 5 : cho 11,8g hỗn hợp X (Al ;M hoá trị không đổi) tác dụng với 150mml [TEX]CuSO_4 [/TEX] 2M .cho 5,9 g hỗn hợp X tác dụng với [TEX]HNO_3[/TEX] (đ) thu được 0,4 mol [TEX]NO_2[/TEX] (spkdn) KL M là :
A. Cu
B Mg
C Fe
D Zn
bảo toàn e : ( X với CuSO4 )
3x + ny = 0,6 (1)
bảo toàn e : ( X với HNO3 )
ta thấy số gam hỗn hợp X ở 2 tăng gấp đôi => e tăng gấp đôi
3x + ny = 0,4.2 = 0,8 (2)
(1)(2) ta thấy cùng với 3x + ny mà cho ra số mol khác nhau ở 2 lần phản ứng vậy trong lần phản ứng thứ nhất sẽ có 1 kim loại không phản ứng với CuSO4 , vậy đó chỉ có thể là Cu => A