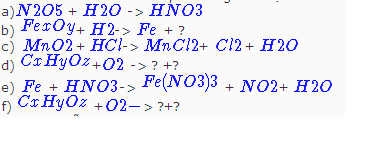L
lililovely
Môn: Hoá học – lớp 8. Thời gian làm bài: 90 phút
1) Cho các PTHH sau PTHH nào đúng, PTHH nào sai? Vì sao?
a) 2 Al + 6 HCl ( 2 AlCl3 + 3H2 (; b) 2 Fe + 6 HCl ( 2 FeCl3 + 3H2(
c) Cu + 2 HCl ( CuCl2 + H2 ( ; d) CH4 + 2 O2 ( SO2 ( + 2 H2O
2) Chọn câu phát biểu đúng và cho ví dụ:
a) Oxit axit thường là oxit của phi kim và tương ứng với một axit.
b) Oxit axit là oxit của phi kim và tương ứng với một axit.
c) Oxit bazơ thường là oxit của kim loại và tương ứng với một bazơ.
d) Oxit bazơ là oxit của kim loại và tương ứng với một bazơ.
3) Hoàn thành các PTHH sau:
a) C4H9OH + O2 ( CO2 ( + H2O ; b) CnH2n - 2 + ? ( CO2 ( + H2O
c) KMnO4 + ? ( KCl + MnCl2 + Cl2 ( + H2O
d) Al + H2SO4(đặc, nóng) ( Al2(SO4)3 + SO2 ( + H2O
Bài 2: Tính số mol nguyên tử và số mol phân tử oxi có trong 16,0 g khí sunfuric.
(giả sử các nguyên tử oxi trong khí sunfuric tách ra và liên kết với nhau tạo thành các phân tử oxi).
Bài 3: Đốt cháy hoàn toàn khí A cần dùng hết 8,96 dm3 khí oxi thu được 4,48 dm3 khí CO2 và 7,2g hơi nước.
a) A do những nguyên tố nào tạo nên? Tính khối lượng A đã phản ứng.
b) Biết tỷ khối của A so với hiđro là 8. Hãy xác định công thức phân tử của A và gọi tên A.
Bài 4: Cho luồng khí hiđro đi qua ống thuỷ tinh chứa 20 g bột đồng(II) oxit ở 400 0C. Sau phản ứng thu được 16,8 g chất rắn.
a) Nêu hiện tượng phản ứng xảy ra.
b) Tính hiệu suất phản ứng.
c) Tính số lít khí hiđro đã tham gia khử đồng(II) oxit trên ở đktc.
cái này là bổ sung thêm^^
Môn : Hoá học 9
Thời gian làm bài: 150 phút.
(Đề thi gồm 02 trang)
Câu I (3,75 điểm)
1/ sơ đồ biến hóa sau: X ( Y ( Z ( Y ( X. Biết rằng, X là đơn chất của phi kim T; Y, Z là hợp chất gồm hai nguyên tố, trong đó có chứa T. Dung dịch chất Y làm đỏ quỳ tím. Z là muối kali, trong đó kali chiếm 52,35% (về khối lượng) . Xác định công thức các chất X, Y, Z và viết phương trình hóa học biểu diễn các biến hóa trên
2/ 5 lọ bị mất nhãn, mỗi lọ đựng riêng rẽ một trong các dung dịch không màu sau: HCL, NAOH, BA(OH)2, Mgcl2 MgSO4 Nếu chỉ dùng thêm dung dịch phenolphtalein làm thuốc thử, hãy trình bày chi tiết cách phân biệt 5 lọ trên (không trình bày ở dạng bảng hoặc sơ đồ) và viết phương trình hóa học của các phản ứng xảy ra.
Câu II (2,25 điểm)
1/ Cho mẩu kim loại Na có khối lượng m gam tan hoàn toàn trong lọ đựng 174 ml dung dịch 10% (khối lượng riêng là 1,05 g/ml).
a) Viết phương trình hóa học của các phản ứng có thể xảy ra.
b) Với giá trị như thế nào của m, dung dịch thu được có
- tính axit (với ph <7)?
- tính bazơ (với ph >7)?
2/ Trong một dung dịch mol nguyên tử oxi 1,25 lần số mol nguyên tử hiđro.
a) Tính nồng độ phần trăm của dung dịch axit trên.
b) Lấy 46,4 gam dung dịch axit trên đun nóng với Cu thấy thoát ra khí SO2 sau phản ứng nồng độ dung dịch axit còn lại là 52,8%. Viết phương trình hóa học và tính khối lượng đồng đã phản ứng.
Câu III (4,5 điểm)
1/ hai thanh kim loại M với khối lượng bằng nhau, cho thanh thứ nhất vào dung dịch muối Q(NO3)2 cho thanh thứ hai vào dung dịch R(NO3)2 sau một thời gian phản ứng, người ta lấy hai thanh kim loại ra, rửa sạch, đem cân rồi so với khối lượng ban đầu thấy ở thanh kim loại thứ nhất khối lợng giảm x%, còn ở thanh thứ hai khối lượng tăng y%.
a) Viết phương trình hóa học của các phản ứng.
b) Biết M có khối lượng mol là M (g/mol) và M có hóa trị II trong hợp chất; kim loại Q trong muối Q(NO3)2, kim loại R trong muối R(NO3)2 có khối lượng mol lần lượt là Q (g/mol) và R(g/mol); cho rằng lượng kim loại M tham gia phản ứng trong hai thí nghiệm bằng nhau và toàn bộ lượng kim loại sinh ra bám hoàn toàn vào thanh kim loại. Tìm M theo x,y,Q,R.
2/ Cho hỗn hợp bột A gồm , Vào dung dịch chứa BA(HCO3)2 khuấy đều, đem lọc thu được dung dịch X và chất rắn Y. Dung dịch X có thể tác dụng được vừa hết với 0,08 mol NaOH hoặc với 0,1 mol HCl. Hòa tan chất rắn Y vào dung dịch HCl dư, khí CO2 thoát ra được hấp thụ toàn bộ vào dung dịch Ca(OH)2 dư thu được 16 gam kết tủa. Viết phương trình hóa học của các phan ứng và tìm khối lượng
ĐỀ 5
Bài 1: 1) Cho các PTHH sau PTHH nào đúng, PTHH nào sai? Vì sao?
a) 2 Al + 6 HCl ( 2 AlCl3 + 3H2 (; b) 2 Fe + 6 HCl ( 2 FeCl3 + 3H2(
c) Cu + 2 HCl ( CuCl2 + H2 ( ; d) CH4 + 2 O2 ( SO2 ( + 2 H2O
2) Chọn câu phát biểu đúng và cho ví dụ:
a) Oxit axit thường là oxit của phi kim và tương ứng với một axit.
b) Oxit axit là oxit của phi kim và tương ứng với một axit.
c) Oxit bazơ thường là oxit của kim loại và tương ứng với một bazơ.
d) Oxit bazơ là oxit của kim loại và tương ứng với một bazơ.
3) Hoàn thành các PTHH sau:
a) C4H9OH + O2 ( CO2 ( + H2O ; b) CnH2n - 2 + ? ( CO2 ( + H2O
c) KMnO4 + ? ( KCl + MnCl2 + Cl2 ( + H2O
d) Al + H2SO4(đặc, nóng) ( Al2(SO4)3 + SO2 ( + H2O
Bài 2: Tính số mol nguyên tử và số mol phân tử oxi có trong 16,0 g khí sunfuric.
(giả sử các nguyên tử oxi trong khí sunfuric tách ra và liên kết với nhau tạo thành các phân tử oxi).
Bài 3: Đốt cháy hoàn toàn khí A cần dùng hết 8,96 dm3 khí oxi thu được 4,48 dm3 khí CO2 và 7,2g hơi nước.
a) A do những nguyên tố nào tạo nên? Tính khối lượng A đã phản ứng.
b) Biết tỷ khối của A so với hiđro là 8. Hãy xác định công thức phân tử của A và gọi tên A.
Bài 4: Cho luồng khí hiđro đi qua ống thuỷ tinh chứa 20 g bột đồng(II) oxit ở 400 0C. Sau phản ứng thu được 16,8 g chất rắn.
a) Nêu hiện tượng phản ứng xảy ra.
b) Tính hiệu suất phản ứng.
c) Tính số lít khí hiđro đã tham gia khử đồng(II) oxit trên ở đktc.
cái này là bổ sung thêm^^
Môn : Hoá học 9
Thời gian làm bài: 150 phút.
(Đề thi gồm 02 trang)
Câu I (3,75 điểm)
1/ sơ đồ biến hóa sau: X ( Y ( Z ( Y ( X. Biết rằng, X là đơn chất của phi kim T; Y, Z là hợp chất gồm hai nguyên tố, trong đó có chứa T. Dung dịch chất Y làm đỏ quỳ tím. Z là muối kali, trong đó kali chiếm 52,35% (về khối lượng) . Xác định công thức các chất X, Y, Z và viết phương trình hóa học biểu diễn các biến hóa trên
2/ 5 lọ bị mất nhãn, mỗi lọ đựng riêng rẽ một trong các dung dịch không màu sau: HCL, NAOH, BA(OH)2, Mgcl2 MgSO4 Nếu chỉ dùng thêm dung dịch phenolphtalein làm thuốc thử, hãy trình bày chi tiết cách phân biệt 5 lọ trên (không trình bày ở dạng bảng hoặc sơ đồ) và viết phương trình hóa học của các phản ứng xảy ra.
Câu II (2,25 điểm)
1/ Cho mẩu kim loại Na có khối lượng m gam tan hoàn toàn trong lọ đựng 174 ml dung dịch 10% (khối lượng riêng là 1,05 g/ml).
a) Viết phương trình hóa học của các phản ứng có thể xảy ra.
b) Với giá trị như thế nào của m, dung dịch thu được có
- tính axit (với ph <7)?
- tính bazơ (với ph >7)?
2/ Trong một dung dịch mol nguyên tử oxi 1,25 lần số mol nguyên tử hiđro.
a) Tính nồng độ phần trăm của dung dịch axit trên.
b) Lấy 46,4 gam dung dịch axit trên đun nóng với Cu thấy thoát ra khí SO2 sau phản ứng nồng độ dung dịch axit còn lại là 52,8%. Viết phương trình hóa học và tính khối lượng đồng đã phản ứng.
Câu III (4,5 điểm)
1/ hai thanh kim loại M với khối lượng bằng nhau, cho thanh thứ nhất vào dung dịch muối Q(NO3)2 cho thanh thứ hai vào dung dịch R(NO3)2 sau một thời gian phản ứng, người ta lấy hai thanh kim loại ra, rửa sạch, đem cân rồi so với khối lượng ban đầu thấy ở thanh kim loại thứ nhất khối lợng giảm x%, còn ở thanh thứ hai khối lượng tăng y%.
a) Viết phương trình hóa học của các phản ứng.
b) Biết M có khối lượng mol là M (g/mol) và M có hóa trị II trong hợp chất; kim loại Q trong muối Q(NO3)2, kim loại R trong muối R(NO3)2 có khối lượng mol lần lượt là Q (g/mol) và R(g/mol); cho rằng lượng kim loại M tham gia phản ứng trong hai thí nghiệm bằng nhau và toàn bộ lượng kim loại sinh ra bám hoàn toàn vào thanh kim loại. Tìm M theo x,y,Q,R.
2/ Cho hỗn hợp bột A gồm , Vào dung dịch chứa BA(HCO3)2 khuấy đều, đem lọc thu được dung dịch X và chất rắn Y. Dung dịch X có thể tác dụng được vừa hết với 0,08 mol NaOH hoặc với 0,1 mol HCl. Hòa tan chất rắn Y vào dung dịch HCl dư, khí CO2 thoát ra được hấp thụ toàn bộ vào dung dịch Ca(OH)2 dư thu được 16 gam kết tủa. Viết phương trình hóa học của các phan ứng và tìm khối lượng
Last edited by a moderator: