- 29 Tháng sáu 2017
- 5,209
- 8,405
- 944
- 25
- Cần Thơ
- Đại học Cần Thơ
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chào các bạn!!!
Sắp đến thời gian thi học kỳ 1 rồi nhỉ??? Chắc hẳn một số bạn vẫn còn đang bâng khuâng về những vấn đề mình chưa giải quyết xong trước khi kỳ thi bắt đầu. Hôm nay, BQT box Hóa sẽ giúp bạn giải quyết tất cả qua topic ôn thi học kỳ 1 dành cho các bạn học sinh lớp 9 (các bạn khối lớp khác cũng đừng lo, BQT đang cập nhật và sẽ sớm đưa ra trong thời gian sớm nhất).
Vì đây là topic ôn luyện nên các bạn TỰ DO trả lời các bài tập, hay những vấn đề liên quan đến môn học, nhưng tuyệt đối không spam với mọi hình thức nha!!!
Nào trước khi bắt đầu, chúng ta hãy điểm qua những nội dung có thể có trong đề thi học kỳ 1 sắp tới:
- Tính chất hóa học của : oxit, axit, bazơ, muối, kim loại, phi kim
- Tính chất hóa học của axit sunfuaric đặc, nhôm, clo.
- Phân bón hóa học.
- Các biện pháp chống ăn mòn kim loại
- Dãy hoạt động hóa học của kim loại và ý nghĩa của nó.
- Tính chất vật lý của CaO, SO2, H2SO4, NaOH, Al,Fe, Cl2.
- Điều chế: SO2 , CaO, H2SO4, NaOH, Al, Cl2
- Ứng dụng của CaO, NaCl, Al, Fe ( gang- thép)
- Điều kiện để phản ứng xảy ra trong dung dịch.
- Lưu ý học lại tính tan và xem các hiện tương xảy ra trong các thí ngiệm trong sgk, màu sắc của các chất, các dung dịch dã biết.
II. Các dạng bài tập:
- Viết các pthh minh họa cho tính chất hóa học, ứng dụng của các chất, pthh điều chế các chất.
- Dựa vào tính chất hóa học, vật lý giải thích các ứng dụng, các hiện tượng thường gặp.
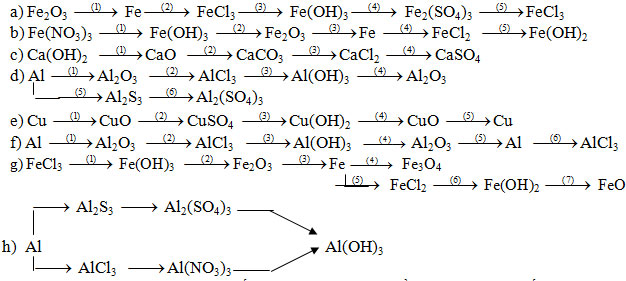
- Viết pthh hoàn thành dãy chuyển hóa, thể hiện mối quan hệ giữa các loại hợp chất vô cơ.
- Phân biệt, nhận biết các chất bằng phương pháp vật lý, hóa học.
- Các bài tập định lượng : áp dụng tính theo pthh, định luật bảo toàn khối lượng , tính nồng độ dung dịch, tính khối lượng kết tủa, tính thể tích chất khí (đktc), tính thành phần trong hỗn hợp ban đầu hoặc hổn hợp sản phẩm, xác định tên nguyên tố. ..
III. Phần mở rộng.
- Áp dụng các kiến thức mở rộng trong phần em có biết.
- Phản ứng giữa oxit axit với dung bazơ.
- Phản ứng giữa kim loại với axit sunfuaric đặc nóng.
- Phản ứng giữa Al, Zn với dung dịch bazơ.
Sắp đến thời gian thi học kỳ 1 rồi nhỉ??? Chắc hẳn một số bạn vẫn còn đang bâng khuâng về những vấn đề mình chưa giải quyết xong trước khi kỳ thi bắt đầu. Hôm nay, BQT box Hóa sẽ giúp bạn giải quyết tất cả qua topic ôn thi học kỳ 1 dành cho các bạn học sinh lớp 9 (các bạn khối lớp khác cũng đừng lo, BQT đang cập nhật và sẽ sớm đưa ra trong thời gian sớm nhất).
Vì đây là topic ôn luyện nên các bạn TỰ DO trả lời các bài tập, hay những vấn đề liên quan đến môn học, nhưng tuyệt đối không spam với mọi hình thức nha!!!
Nào trước khi bắt đầu, chúng ta hãy điểm qua những nội dung có thể có trong đề thi học kỳ 1 sắp tới:
*****
PHẦN 1: NHỮNG NỘI DUNG CÓ TRONG ĐỀ THI HỌC KỲ 1 MÔN HÓA 9
I. Lý thuyết :PHẦN 1: NHỮNG NỘI DUNG CÓ TRONG ĐỀ THI HỌC KỲ 1 MÔN HÓA 9
- Tính chất hóa học của : oxit, axit, bazơ, muối, kim loại, phi kim
- Tính chất hóa học của axit sunfuaric đặc, nhôm, clo.
- Phân bón hóa học.
- Các biện pháp chống ăn mòn kim loại
- Dãy hoạt động hóa học của kim loại và ý nghĩa của nó.
- Tính chất vật lý của CaO, SO2, H2SO4, NaOH, Al,Fe, Cl2.
- Điều chế: SO2 , CaO, H2SO4, NaOH, Al, Cl2
- Ứng dụng của CaO, NaCl, Al, Fe ( gang- thép)
- Điều kiện để phản ứng xảy ra trong dung dịch.
- Lưu ý học lại tính tan và xem các hiện tương xảy ra trong các thí ngiệm trong sgk, màu sắc của các chất, các dung dịch dã biết.
II. Các dạng bài tập:
- Viết các pthh minh họa cho tính chất hóa học, ứng dụng của các chất, pthh điều chế các chất.
- Dựa vào tính chất hóa học, vật lý giải thích các ứng dụng, các hiện tượng thường gặp.
- Viết pthh hoàn thành dãy chuyển hóa, thể hiện mối quan hệ giữa các loại hợp chất vô cơ.
- Phân biệt, nhận biết các chất bằng phương pháp vật lý, hóa học.
- Các bài tập định lượng : áp dụng tính theo pthh, định luật bảo toàn khối lượng , tính nồng độ dung dịch, tính khối lượng kết tủa, tính thể tích chất khí (đktc), tính thành phần trong hỗn hợp ban đầu hoặc hổn hợp sản phẩm, xác định tên nguyên tố. ..
III. Phần mở rộng.
- Áp dụng các kiến thức mở rộng trong phần em có biết.
- Phản ứng giữa oxit axit với dung bazơ.
- Phản ứng giữa kim loại với axit sunfuaric đặc nóng.
- Phản ứng giữa Al, Zn với dung dịch bazơ.