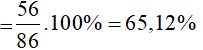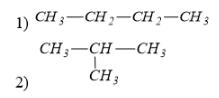- 26 Tháng tám 2021
- 1,369
- 1,660
- 216
- Bình Định
- Viện dầu và cây có dầu
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Hi Cả nhà 

Chỉ còn 1 tuần nữa là các bạn lớp 9 đã bước vào kì thi HK2 rồi.... Vậy hãy cùng nhà HMF làm 1 số Đề thi học kì 2 môn Hóa dưới đây nhé ( Chúng mình có có lời giải và khổ điểm từng câu cho các bạn tham khảo luôn nhé ^ ^)
Phần I: Trắc nghiệm (3 điểm) Chọn một trong các chữ cái A, B, C, D trước câu trả lời đúng:( Mỗi câu trả lời đúng được 0,5 điểm)
Câu 1: Số thứ tự của nhóm cho biết:
A. Số electron lớp ngoài cùng
B. Số lớp electron
C. Kí hiệu hóa học và tên nguyên tố
D. nguyên tử khối của nguyên tố
Câu 2: Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân nguyên tử thì:
A. Tính kim loại và tính phi kim đều giảm.
B. Tính kim loại giảm dần, tính phi kim tăng dần.
C. Tính kim loại và phi kim đều tăng.
D. Tính kim loại tăng dần, tính phi kim giảm dần.
Câu 3: Dãy đều gồm các hợp chất hữu cơ là:
A. [imath]CH_4, C_2H_6O, CaO[/imath]
B. [imath]CH_3COOH, HCl, CH_3OH[/imath]
C. [imath]CH_3COONa, CaCl_2, C_2H_5Cl[/imath]
D. [imath]C_2H_6O, C_6H_{12}O_6, C_{12}H_{22}O_{11}[/imath]
Câu 4: Hòa tan hoàn toàn 32,5 gam Zn trong 200 g dung dịch [imath]CH_3COOH[/imath] a%, vừa đủ. Giá trị của a là
A. 15 %
B. 30 %
C. 45 %
D. 60%
Câu 5: Dẫn từ từ 4,48 lít ( ở điều kiện tiêu chuẩn) hỗn hợp X gồm [imath]CH_4, C_2H_4[/imath] qua dung dịch Brom dư, thấy khối lượng Brom phản ứng là 16 gam. Thành phần phần trăm về thể tích của [imath]CH_4, C_2H_4[/imath] trong hỗn hợp X là: :
A. 25% và 75%
B. 75% và 25%
C. 50 % và 50%
D. 40 % và 60%
Câu 6: Có ba dung dịch : rượu etylic, axit axetic, glucozơ. Để phân biệt ba dung dịch trên cần dùng :
A. Quỳ tím, [imath]Ag_2O[/imath] trong dung dịch Amonniac
B. NaOH, [imath]Ag_2O[/imath] trong dung dịch Amoniac
C. Zn, NaOH
D. NaOH, quỳ tím.
Phần II : Tự Luận ( 7 điểm)
Câu 1: (2 điểm) Viết các phương trình hóa học thực hiện dãy chuyển hóa sau:
[imath]CH_4 → C_2H_2 → C_2H_4 → CH_3–CH_2–OH → CH_3–COOH→ CH_3–COOC_2H_5[/imath]
Câu 2: (1,5 điểm)
Có 3 lọ không nhãn đựng 3 dung dịch không màu: hồ tinh bột, glucozơ, saccarozo.
Hãy nêu cách nhận biết các chất trên bằng phương pháp hóa học.
Câu 3: (2,5 điểm) Hòa tan hoàn toàn 11,3 g hốn hợp A gồm Mg, Zn trong 200 g dung dịch CH3-COOH nồng độ a % ,vừa đủ tạo thành dung dịch A; 6,72 lít khí Hidro ở điều kiện tiêu chuẩn. Hãy:
a, Viết phương trình hóa học của phản ứng trên ?
b, Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp A ban đầu?
c, Tính nồng độ phần trăm của dung dịch [imath]CH_3-COOH[/imath] đã dùng và dung dịch muối thu được sau phản ứng?
Câu 4: (1,0 điểm) Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ A thu được 17,6 g khí [imath]CO_2[/imath] và 9 g [imath]H_2O[/imath]. Biết phân tử chất A chỉ chứa một nguyên tử oxi trong phân tử và tác dụng được với Natri giải phóng H2. Hãy xác định công thức phân tử và công thức cấu tạo có thể có của A.
(Biết H=1;C=12;O=16;S=32, Cl =35,5; Mg = 24; Fe = 56, Zn=65)
@Hanhan_2007 , @dio and jotaro , @huyenthuong18 , @Jannie Nguyen , @mosogourmet , @mynhchow , @nguyenquangtruc4901@gmail.com , @thanhnghi05 cùng làm thôi nào......
Chỉ còn 1 tuần nữa là các bạn lớp 9 đã bước vào kì thi HK2 rồi.... Vậy hãy cùng nhà HMF làm 1 số Đề thi học kì 2 môn Hóa dưới đây nhé ( Chúng mình có có lời giải và khổ điểm từng câu cho các bạn tham khảo luôn nhé ^ ^)
ĐỀ THI HỌC KÌ II lớp 9
Đề 1
Đề 1
Phần I: Trắc nghiệm (3 điểm) Chọn một trong các chữ cái A, B, C, D trước câu trả lời đúng:( Mỗi câu trả lời đúng được 0,5 điểm)
Câu 1: Số thứ tự của nhóm cho biết:
A. Số electron lớp ngoài cùng
B. Số lớp electron
C. Kí hiệu hóa học và tên nguyên tố
D. nguyên tử khối của nguyên tố
Câu 2: Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân nguyên tử thì:
A. Tính kim loại và tính phi kim đều giảm.
B. Tính kim loại giảm dần, tính phi kim tăng dần.
C. Tính kim loại và phi kim đều tăng.
D. Tính kim loại tăng dần, tính phi kim giảm dần.
Câu 3: Dãy đều gồm các hợp chất hữu cơ là:
A. [imath]CH_4, C_2H_6O, CaO[/imath]
B. [imath]CH_3COOH, HCl, CH_3OH[/imath]
C. [imath]CH_3COONa, CaCl_2, C_2H_5Cl[/imath]
D. [imath]C_2H_6O, C_6H_{12}O_6, C_{12}H_{22}O_{11}[/imath]
Câu 4: Hòa tan hoàn toàn 32,5 gam Zn trong 200 g dung dịch [imath]CH_3COOH[/imath] a%, vừa đủ. Giá trị của a là
A. 15 %
B. 30 %
C. 45 %
D. 60%
Câu 5: Dẫn từ từ 4,48 lít ( ở điều kiện tiêu chuẩn) hỗn hợp X gồm [imath]CH_4, C_2H_4[/imath] qua dung dịch Brom dư, thấy khối lượng Brom phản ứng là 16 gam. Thành phần phần trăm về thể tích của [imath]CH_4, C_2H_4[/imath] trong hỗn hợp X là: :
A. 25% và 75%
B. 75% và 25%
C. 50 % và 50%
D. 40 % và 60%
Câu 6: Có ba dung dịch : rượu etylic, axit axetic, glucozơ. Để phân biệt ba dung dịch trên cần dùng :
A. Quỳ tím, [imath]Ag_2O[/imath] trong dung dịch Amonniac
B. NaOH, [imath]Ag_2O[/imath] trong dung dịch Amoniac
C. Zn, NaOH
D. NaOH, quỳ tím.
Phần II : Tự Luận ( 7 điểm)
Câu 1: (2 điểm) Viết các phương trình hóa học thực hiện dãy chuyển hóa sau:
[imath]CH_4 → C_2H_2 → C_2H_4 → CH_3–CH_2–OH → CH_3–COOH→ CH_3–COOC_2H_5[/imath]
Câu 2: (1,5 điểm)
Có 3 lọ không nhãn đựng 3 dung dịch không màu: hồ tinh bột, glucozơ, saccarozo.
Hãy nêu cách nhận biết các chất trên bằng phương pháp hóa học.
Câu 3: (2,5 điểm) Hòa tan hoàn toàn 11,3 g hốn hợp A gồm Mg, Zn trong 200 g dung dịch CH3-COOH nồng độ a % ,vừa đủ tạo thành dung dịch A; 6,72 lít khí Hidro ở điều kiện tiêu chuẩn. Hãy:
a, Viết phương trình hóa học của phản ứng trên ?
b, Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp A ban đầu?
c, Tính nồng độ phần trăm của dung dịch [imath]CH_3-COOH[/imath] đã dùng và dung dịch muối thu được sau phản ứng?
Câu 4: (1,0 điểm) Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ A thu được 17,6 g khí [imath]CO_2[/imath] và 9 g [imath]H_2O[/imath]. Biết phân tử chất A chỉ chứa một nguyên tử oxi trong phân tử và tác dụng được với Natri giải phóng H2. Hãy xác định công thức phân tử và công thức cấu tạo có thể có của A.
(Biết H=1;C=12;O=16;S=32, Cl =35,5; Mg = 24; Fe = 56, Zn=65)
@Hanhan_2007 , @dio and jotaro , @huyenthuong18 , @Jannie Nguyen , @mosogourmet , @mynhchow , @nguyenquangtruc4901@gmail.com , @thanhnghi05 cùng làm thôi nào......
Last edited: