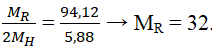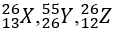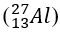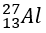Bài 1: Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành 1 cột.
D. Cả A, B, C.
Bài 2: Chu kì là:
A. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều khối lượng nguyên tử tăng dần.
B. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số khối tăng dần.
C. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân nguyên tử tăng dần.
D. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số nơtron tăng dần.
Bài 3: Nhóm nguyên tố là:
A. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron giống nhau, được xếp ở cùng một cột.
B. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hoá học giống nhau và được xếp thành một cột.
C. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau và được xếp thành một cột.
D. Tập hợp các nguyên tố mà nguyên tử có tính chất hoá học giống nhau và được xếp cùng một cột.
Bài 4: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn:
A. 3 và 3
B. 4 và 3
C. 4 và 4
D. 3 và 4
Bài 5: Trong bảng tuần hoàn, chu kỳ nhỏ là những chu kỳ nào sau đây?
A. 1
B. 2
C. 3
D. Cả 3 chu kỳ 1, 2, 3.
Bài 6: Nguyên tử các nguyên tố thuộc chu kỳ 3 có số lớp electron trong nguyên tử là:
A. 3
B. 4
C. 5
D. 6.
Bài 7: Số nguyên tố thuộc chu kỳ 3 là
A. 8
B. 18
C. 32
D. 50
Giải thích:
Các chu kì 2,3 là chu kì nhỏ, có 8 nguyên tố trong 1 chu kì
Các chu kì 4,5,6 là các chu kì lớn, có 18 nguyên tố trong 1 chu kì.
Bài 8: Nguyên tử các nguyên tố thuộc nhóm VA có số electron lớp ngoài cùng là:
A. 4
B. 3
C. 5
D. 1
Bài 9: Nguyên tử các nguyên tố thuộc nhóm IIIA có số electron độc thân là:
A. 3
B. 1
C. 2
D. 0
Bài 10: Nhận định nào sau đây không đúng?
A. Chu kỳ gồm các nguyên tử có số lớp electron bằng nhau.
B
. Trong bảng tuần hoàn các nguyên tố được xếp theo chiều tăng của khối lượng nguyên tử.
C. Các nguyên tử có số lớp electron bằng nhau xếp cùng một hàng.
D. Các nguyên tử có số electron hoá trị bằng nhau xếp cùng một cột.
Giải thích: Trong bảng tuần hoàn các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân.
Bài 11: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z= 11) là
A. 1s22s22p63s2
B. 1s22s22p53s2
C. 1s22s22p43s1
D. 1s22s22p63s1
Giải thích: Cấu hình electron của Na(Z=11): 1s22s22p63s1
Bài 12: Một nguyên tố thuộc nhóm VIA, chu kỳ 3. Điện tích hạt nhân của nguyên tử nguyên tố đó là:
A. 13+
B. 14+
C. 15+
D. 16+
Giải thích:
Nhóm VIA ⇒ có 6 electron lớp ngoài cùng
Chu kì 3 ⇒ có 3 lớp eletron
⇒ Cấu hình electrong: 1s22s22p63s2 p4 ⇒ Z=16
Bài 13: Nguyên tố Se (Z=34). Vị trí của Se là
A. Ô 34, chu kỳ 4, nhóm VIA.
B. Ô 34, chu kỳ 4, nhóm VIB
C. Ô 34, chu kỳ 4, nhóm VA.
D. Ô 34, chu kỳ 4, nhóm VB.
Giải thích:
34= 2+8+18+6 ⇒ cấu hình [...]3d104s24p6
⇒ Se thuộc chu kì 4, nhóm VIA
Bài 14: Cho cấu hình electron của Mn [Ar]3d54s2. Mn thuộc nguyên tố nào?
A. Nguyên tố s
B. Nguyên tố p
C. Nguyên tố d
D. Nguyên tố f
Giải thích:
Trật tự các mức năng lượng tăng dần theo trình tự sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Do đó nguyên tử Mn có electron cuối cùng được điền vào phân lớp d nên là nguyên tố d.
Bài 15: Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
A. tăng theo chiều tăng của điện tích hạt nhân.
B. giảm theo chiều tăng của điện tích hạt nhân.
C. tăng theo chiều tăng của tính kim loại.
D. A và C đều đúng.
Bài 16: Nguyên tố ở chu kỳ 4, nhóm VIA có cấu hình electron hóa trị là
A. …4s24p6.
B. …4s24p4.
C. …5s25p5.
D. …5s25p4.
Hiển thị đáp án
Giải thích: Chu kì 4: có 4 lớp electron, nhóm VIA : có 6eletron lớp ngoài cùng.
Bài 17: Cho nguyên tố có STT là 17, vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hoá học là:
A. Ô số 17, chu kì 3, nhóm VIIA.
B. Ô số 17, chu kì 3, nhóm IA.
C. Ô số 17, chu kì 4, nhóm IIA.
D. Ô số 17, chu kì 3, nhóm IIA.
Giải thích:
17=2+8+7 ⇒ [...] 3s23p5
Có 3 lớp electron: thuộc chu kì 3, có 7 electron lớp ngoài cùng nên thuộc nhóm VIIA.
Bài 18: Cho nguyên tố có STT là 19 có bao nhiêu electron độc thân
A. 1
B. 2
C. 3
D. 4
Giải thích: 19=2+8+8+1 ⇒ [...]4s1
Lưu ý khi Z > 20, phân lớp 3d xuất hiện có mức năng lượng lớn hơn 4s khi đó ở lớp 3 thay vì có 8electron sẽ có 18electron.
Bài 19: Nguyên tố R thuộc nhóm VIA. Công thức oxit cao nhất của R và công thức hợp chất với hiđro là
A. R2O5 và RH .
B. RO2 và RH4.
C. R2O7 và RH.
D. RO3 và RH2
Giải thích:
Hóa trị cao nhất với oxi là 6, hóa trị thấp nhất với hidro là 8-6=2.
⇒ Công thức: RO3 và RH2
Bài 20: Công thức chung của các oxit kim loại nhóm IA là
A. R2O.
B. RO2 .
C. RO.
D. R2O3
Bài 21: Nhận định nào sau đây đúng khi nói về 3 nguyên tử :
A. X và Z có cùng số khối
B. X,Z là 2 đồng vị của cùng một nguyên tố hóa học
C. X,Y thuộc cùng một nguyên tố hóa học
D. X và Y có cùng số nơtron
Giải thích:
A đúng vì Ax = Az
B sai vì X và Z không có cùng số proton → không là 2 đồng vị của cùng một nguyên tố hóa học
C sai vì X và Y không cùng điện tích hạt nhân → không thuộc cùng một nguyên tố hóa học
D vì X và Y khác nhau số nơtron
Bài 22: Số proton và số nơtron có trong một nguyên tử nhôm
lần lượt là
A. 13 và 14
B. 13 và 15
C. 12 và 14
D. 13 và 13
Giải thích:
→ p=13 , n=27-13=14
Bài 23: Cation R+ có cấu hình electron phân lớp ngoài cùng là 3p6. Vị trí của R trong bảng tuần hoàn là
A. Ô thứ 20, nhóm IIA, chu kỳ 4.
B. Ô thứ 19, nhóm IB, chu kỳ 4
C. Ô thứ 19, nhóm IA, chu kỳ 4.
D. Ô thứ 17, nhóm VIIA, chu kỳ 3
Giải thích:
Cấu hình electron của R+ : [...]3p6
⇒ Cấu hình electron của R: [...]3p64s1
Có 19electron: thuộc ô 19,
có 4 lớp electron: thuộc chu kì 4,
có 1 electron lớp ngoài cùng: nhóm IA.
Bài 24: Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
A. O (Z=8)
B. Cl (Z=17)
C. Al (Z=13)
D. Si (Z=14)
Giải thích:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p
→ Cấu hình electron của X là 1s22s22p63s23p2
→ Z=14 → X là Si
Bài 25: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L ( lớp thứ 2). Số proton có trong nguyên tử X là
A. 7
B. 6
C. 8
D. 5
Giải thích:
Nguyên tử nguyên tố X có 4 electron ở lớp L
→ X có 2 electron ở phân lớp 2s và 2 electron ở phân lớp 2p
→ Cấu hình electron của X là 1s22s22p2 → Z=6
Bài 26: anion X2- có cấu hình electron: 1s22s22p63s23p6. Nguyên tử nguyên tố X thuộc
A. Chu kỳ 3 nhóm VIA.
B. Chu kỳ 3 nhóm VIIIA.
C. Chu kỳ 4 nhóm IIA.
D. Chu kỳ 4 nhóm VIA.
Giải thích:
Cấu hình electron của X: 1s22s22p63s23p4
⇒ X thuộc chu kì 3, nhóm VIA
Bài 27: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
A. 12.
B. 13.
C. 11.
D. 14.
Giải thích:
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2
Cấu hình e của X là: 1s22s22p63s2
X có 12 e nên có 12 p nên số hiệu nguyên tử của nguyên tố X là 12.
Bài 28: Nguyên tố hóa học X có Z = 20, chu kì 4 nhóm IIA. Điều khẳng định nào sau đây là sai?
A. Số electron trên lớp vỏ là 20
B. Vỏ nguyên tử có 4 lớp electron và có 2 electron lớp ngoài cùng
C. Hạt nhân nguyên tử có 20 proton
D. Nguyên tố hóa học này là phi kim
Giải thích:
X thuộc nhóm IIA: có 2 e lớp ngoài cùng nên có tính kim loại
(Các nguyên tố có 1,2,3 e lớp ngoài cùng có xu hướng nhường e, có tính kim loại)
Bài 29: Nguyên tử của nguyên tố nào sau đây có khuynh hướng nhường 1 electron trong các phản ứng hóa học?
A. Na ở ô 11 trong bảng tuần hoàn.
B. Mg ở ô 12 trong bảng tuần hoàn.
C. Al ở ô 13 trong bảng tuần hoàn.
D. Si ở ô 14 trong bảng tuần hoàn.
Bài 30: Số hiệu nguyên tử Z của các nguyên tố X, A, M, Q lần lượt là 6, 7, 20, 19. Nhận xét nào sau đây đúng ?
A. Cả 4 nguyên tố trên thuộc 1 chu kì.
B. M, Q thuộc chu kì 4.
C. A, M thuộc chu kì 3.
D. Q thuộc chu kì 3.
Giải thích: Cấu hình e của X, A, M , Q lần lượt là: 1s22s22p2; 1s22s22p3; 1s22s22p63s23p64s2; 1s22s22p63s23p64s1
Bài 31: Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì
A. phi kim mạnh nhất là iot.
B. kim loại mạnh nhất là liti.
C. phi kim mạnh nhất là flo.
D. kim loại yếu nhất là xesi.
Bài 32: Oxit cao nhất của 1 nguyên tố R ứng với công thức RO2. Nguyên tố R đó là
A. Magie.
B. Nitơ.
C. Cacbon.
D. Photpho.
Bài 33: Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là:
A. 3
B. 5
C. 6
D. 7
Bài 34: Tìm câu sai trong các câu sau đây:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm.
B. Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhận tăng dần.
C. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
D. Trong 1 nhóm A theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
Bài 35: Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Hãy xác định câu sai trong các câu sau khi nói về nguyên tử X
A. Lớp ngoài cùng của X có 6 electron
B. Hạt nhân nguyên tử X có 16 electron
C. Trong bảng tuần hoàn X nằm ở chu kì 3
D. X nằm ở nhóm VIA
Giải thích:
Cấu hình đầy đủ của X: 1s22s22p63s23p4
⇒ Có 16 electron, lớp ngoài cùng có 6 e, có 3 lớp e nên thuộc chu kì 3
B sai vì trong hạt nhân có hạt proton và notron không có electron.
#Đây là đáp án của 35 câu đầu, có câu nào thắc mắc thì các bạn cứ hỏi nha
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.