- 23 Tháng chín 2018
- 576
- 781
- 161
- TP Hồ Chí Minh
- Đại học sư phạm tphcm
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Giới thiệu chung về propilen
Gốc CH2=CH-CH2- gọi là 2-propenyl (hay còn gọi là anlyl)
Gốc CH3-CH=CH- là 1-propenyl
Tính chất hóa học của propilen
Phản ứng cộng HBr
CH3-CH=CH2 + HBr → CH3-CH2-CH2-Br
Phản ứng cộng halogen
CH3CH=CH2 + Br2 →CCl4 CH3CHBrCH2Br
CH3CH=CH2 + Cl2 → CH3CHClCH2Cl
Phản ứng cộng nước
CH3-CH=CH2 →H2SO4 CH3-CH-CH3OH + H2O
*Lưu ý: nếu dùng nhiều H2SO4, sẽ tạo thành rượu bậc 2:
CH3-CH=CH2 + H2SO4 → CH32CH-OSO3H
CH32CH-OSO3H + H2O→ CH32CH-OH + H2SO4
Phản ứng cộng BH3 (axit lewis)
Axit lewis đơn giản là một muối kim loại hóa trị 3 có thể tiếp nhận một cặp điện tử và tạo ra liên kết cộng hóa trị phối hợp. Thường dùng là nhôm clorua, sắt(III) clorua, triflorua bo và ytecbi(III) triflo.
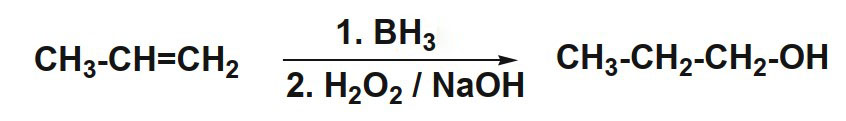
Phản ứng hydro hóa
C3H6 + H2 →Ni /Pd/ Pt C3H8
Phản ứng oxy hóa
3CH3-CH=CH2 + 5K2Cr2O7 + 20H2SO4 → 3CH3COOH + 3CO2 + 5Cr2SO43 + 5K2SO4 + 23H2O
2 C 3 H 6 + 9 O 2 →to 6 CO 2 + 6 H 2 O
Khi không đủ oxy để đốt cháy hoàn toàn, quá trình đốt cháy không hoàn toàn xảy ra cho phép carbon monoxide và / hoặc bồ hóng ( carbon ) cũng được hình thành.
C3H6 + 2 O2 → 3 H2O + 2 C + CO
Phản ứng polyme hóa
nCH2=CH–CH3 →to, xt, p -CH2–CHCH3-n (Polipropilen hay nhựa PP)
Các phương pháp điều chế propilen
Tách nước từ ancol
CH3CH2CH2OH→H2SO4, 170oCCH3CH=CH2 +H2O
Tách HX từ dẫn xuất của halogen
C3H7Cl + NaOH → C3H6 + NaCl + H2O
Khử dẫn xuất 2 lần thế của halogen
CH3CHBrCH2Br+Zn→toCH3CH=CH2 +ZnBr2
Hydro hóa ankin
C3H4 + H2 →Pd/PbCO3 C3H6
Nhiệt phân este
C3H7-O-COCH3→ C3H6 + CH3COOH
Cracking butan
C4H10→CH4+C3H6
Sản xuất trong công nghiệp
Propene là sản phẩm phụ của quá trình lọc dầu và xử lý khí tự nhiên.
Propene có thể được tách ra bằng cách chưng cất phân đoạn từ hỗn hợp hydrocarbon thu được từ quá trình cracking và các quá trình tinh chế khác; propene cấp nhà máy lọc dầu là khoảng 50 đến 70%.
Ứng dụng
Propilen là sản phẩm khởi đầu quan trọng thứ hai trong ngành hóa dầu sau etilen. Nó là nguyên liệu cho nhiều loại sản phẩm. Các nhà sản xuất nhựa polypropilen chiếm gần hai phần ba nhu cầu. Propene cũng được sử dụng để sản xuất các hóa chất quan trọng như propilen oxit, acrylonitrile, cumen và axit acrylic.
Propilen và benzen được chuyển đổi thành acetone và phenol thông qua quá trình cumene .
Tổng quan về quá trình cumen:
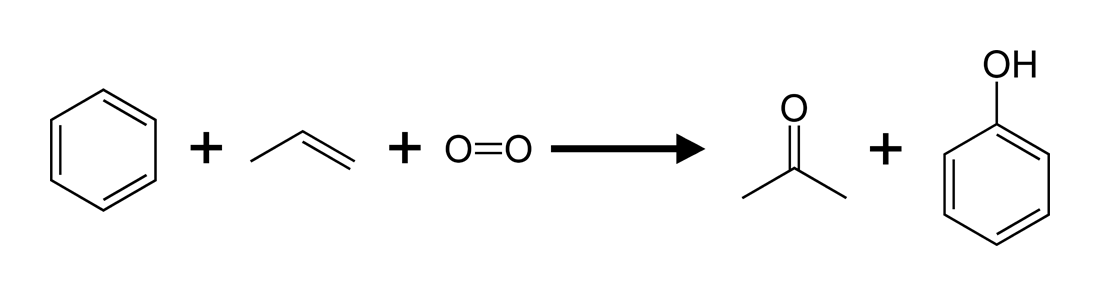
Propilen cũng được sử dụng để sản xuất isopropanol (propan-2-ol), acrylonitril , propilen oxit và epiclorohidric. Propilen cũng là một chất trung gian trong quá trình oxy hóa chọn lọc propan để tạo thành axit acrylic. Trong ngành công nghiệp luyện kim, propilen được sử dụng làm nhiên liệu thay thế cho axetilen trong hàn, cắt và nung kim loại.
- Propilen hay propylen, còn được gọi là propen hoặc methyl ethylen, là một hợp chất hữu cơ hidrocacbon không no mạch hở có công thức hóa học C3H6 CH2=CHCH3
- Nó có một liên kết đôi và là thành viên đơn giản thứ hai trong nhóm hydrocacbon anken sau etylen
- Trong phân tử propilen có liên kết C=C: có 1 liên kết σ & 1 liên kết π hình thành do liên kết của orbital sp2, giữa liên kết C và H có 7 liên kết liên kết σ.
Gốc CH2=CH-CH2- gọi là 2-propenyl (hay còn gọi là anlyl)
Gốc CH3-CH=CH- là 1-propenyl
Tính chất hóa học của propilen
Phản ứng cộng HBr
CH3-CH=CH2 + HBr → CH3-CH2-CH2-Br
Phản ứng cộng halogen
CH3CH=CH2 + Br2 →CCl4 CH3CHBrCH2Br
CH3CH=CH2 + Cl2 → CH3CHClCH2Cl
Phản ứng cộng nước
CH3-CH=CH2 →H2SO4 CH3-CH-CH3OH + H2O
*Lưu ý: nếu dùng nhiều H2SO4, sẽ tạo thành rượu bậc 2:
CH3-CH=CH2 + H2SO4 → CH32CH-OSO3H
CH32CH-OSO3H + H2O→ CH32CH-OH + H2SO4
Phản ứng cộng BH3 (axit lewis)
Axit lewis đơn giản là một muối kim loại hóa trị 3 có thể tiếp nhận một cặp điện tử và tạo ra liên kết cộng hóa trị phối hợp. Thường dùng là nhôm clorua, sắt(III) clorua, triflorua bo và ytecbi(III) triflo.
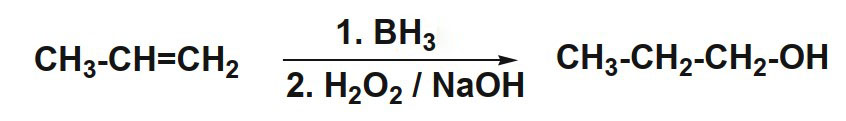
Phản ứng hydro hóa
C3H6 + H2 →Ni /Pd/ Pt C3H8
Phản ứng oxy hóa
- Phản ứng với KMnO4 loãng
- Oxy hóa bằng ddịch KMnO4 , K2Cr2O7 đậm đặc, nhiệt độ cao
3CH3-CH=CH2 + 5K2Cr2O7 + 20H2SO4 → 3CH3COOH + 3CO2 + 5Cr2SO43 + 5K2SO4 + 23H2O
- Phản ứng cháy
2 C 3 H 6 + 9 O 2 →to 6 CO 2 + 6 H 2 O
Khi không đủ oxy để đốt cháy hoàn toàn, quá trình đốt cháy không hoàn toàn xảy ra cho phép carbon monoxide và / hoặc bồ hóng ( carbon ) cũng được hình thành.
C3H6 + 2 O2 → 3 H2O + 2 C + CO
Phản ứng polyme hóa
nCH2=CH–CH3 →to, xt, p -CH2–CHCH3-n (Polipropilen hay nhựa PP)
Các phương pháp điều chế propilen
Tách nước từ ancol
CH3CH2CH2OH→H2SO4, 170oCCH3CH=CH2 +H2O
Tách HX từ dẫn xuất của halogen
C3H7Cl + NaOH → C3H6 + NaCl + H2O
Khử dẫn xuất 2 lần thế của halogen
CH3CHBrCH2Br+Zn→toCH3CH=CH2 +ZnBr2
Hydro hóa ankin
C3H4 + H2 →Pd/PbCO3 C3H6
Nhiệt phân este
C3H7-O-COCH3→ C3H6 + CH3COOH
Cracking butan
C4H10→CH4+C3H6
Sản xuất trong công nghiệp
Propene là sản phẩm phụ của quá trình lọc dầu và xử lý khí tự nhiên.
Propene có thể được tách ra bằng cách chưng cất phân đoạn từ hỗn hợp hydrocarbon thu được từ quá trình cracking và các quá trình tinh chế khác; propene cấp nhà máy lọc dầu là khoảng 50 đến 70%.
Ứng dụng
Propilen là sản phẩm khởi đầu quan trọng thứ hai trong ngành hóa dầu sau etilen. Nó là nguyên liệu cho nhiều loại sản phẩm. Các nhà sản xuất nhựa polypropilen chiếm gần hai phần ba nhu cầu. Propene cũng được sử dụng để sản xuất các hóa chất quan trọng như propilen oxit, acrylonitrile, cumen và axit acrylic.
Propilen và benzen được chuyển đổi thành acetone và phenol thông qua quá trình cumene .
Tổng quan về quá trình cumen:

Propilen cũng được sử dụng để sản xuất isopropanol (propan-2-ol), acrylonitril , propilen oxit và epiclorohidric. Propilen cũng là một chất trung gian trong quá trình oxy hóa chọn lọc propan để tạo thành axit acrylic. Trong ngành công nghiệp luyện kim, propilen được sử dụng làm nhiên liệu thay thế cho axetilen trong hàn, cắt và nung kim loại.

