- 23 Tháng chín 2018
- 576
- 781
- 161
- TP Hồ Chí Minh
- Đại học sư phạm tphcm
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Iot cũng là chất oxi hoá mạnh, nhưng kém clo và brom.
1. Tác dụng với kim loại
- Iot phản ứng trực tiếp với nhiều kim loại, có trường hợp cần đun nóng, có trường hợp xảy ra ở ngay nhiệt độ thường, các phản ứng đều toả ra nhiều nhiệt.
Thí dụ : 2Al + 3I2 → 2AlI3
2. Tác dụng với hidro
- Ở nhiệt độ cao iot mới phản ứng với hiđro :
H2 + I2
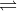 2HI
2HI
- Hiđro iotua không bền, ngay ở những điều kiện tạo thành một phần bị phân huỷ thành hiđro và iot :
2HI
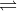 H2 + I2
H2 + I2
- Do vậy, phản ứng giữa hiđro và iot không thực hiện đến cùng.
* Lưu ý:
- Hiđro iotua tan trong nước tạo thành axit tương ứng có cùng công thức: Axit iothiđric HI là axit mạnh.
HF < HCl < HBr < HI
- Không dùng dung dịch H2SO4 đặc và muối iodua để điều chế HI: Tính khử của HI
8HI + H2SO4đ → 4I2 + H2S + 4H2O
3. Phản ứng màu đặc trưng của iot
- Iot tạo thành hợp chất có màu xanh với tinh bột. Do vậy, iot I2 là thuốc thử tinh bột và ngược lại.
4. Halogen mạnh đẩy halogen yếu ra khỏi muối
- Clo, brom đẩy được iot ra khỏi dung dịch NaI.
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
→ Điều đó chứng tỏ rằng clo, brom hoạt động hoá học hơn iot.
5. Tác dụng với chất oxi hóa mạnh
- Iot còn thể hiện tính khử khi tác dụng với chất ôxi hóa mạnh
I2 + 5Cl2 + 6H2O → 2HIO3 + 10HCl
1. Tác dụng với kim loại
- Iot phản ứng trực tiếp với nhiều kim loại, có trường hợp cần đun nóng, có trường hợp xảy ra ở ngay nhiệt độ thường, các phản ứng đều toả ra nhiều nhiệt.
Thí dụ : 2Al + 3I2 → 2AlI3
2. Tác dụng với hidro
- Ở nhiệt độ cao iot mới phản ứng với hiđro :
H2 + I2
- Hiđro iotua không bền, ngay ở những điều kiện tạo thành một phần bị phân huỷ thành hiđro và iot :
2HI
- Do vậy, phản ứng giữa hiđro và iot không thực hiện đến cùng.
* Lưu ý:
- Hiđro iotua tan trong nước tạo thành axit tương ứng có cùng công thức: Axit iothiđric HI là axit mạnh.
HF < HCl < HBr < HI
- Không dùng dung dịch H2SO4 đặc và muối iodua để điều chế HI: Tính khử của HI
8HI + H2SO4đ → 4I2 + H2S + 4H2O
3. Phản ứng màu đặc trưng của iot
- Iot tạo thành hợp chất có màu xanh với tinh bột. Do vậy, iot I2 là thuốc thử tinh bột và ngược lại.
4. Halogen mạnh đẩy halogen yếu ra khỏi muối
- Clo, brom đẩy được iot ra khỏi dung dịch NaI.
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
→ Điều đó chứng tỏ rằng clo, brom hoạt động hoá học hơn iot.
5. Tác dụng với chất oxi hóa mạnh
- Iot còn thể hiện tính khử khi tác dụng với chất ôxi hóa mạnh
I2 + 5Cl2 + 6H2O → 2HIO3 + 10HCl

