- 25 Tháng mười 2018
- 1,560
- 1,681
- 251
- 27
- Quảng Bình
- Đại học Sư phạm Huế
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
LÝ THUYẾT VỀ ĐIỆN PHÂN
I. Khái niệm
Sự điện phân là quá trình oxi hóa – khử xảy ra ở bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
Sự điện phân là quá trình sử dụng điện năng để tạo ra sự biến đổi hóa học.
Trong quá trình điện phân, dưới tác dụng của điện trường, các cation chạy về cực âm (catot) và các anion chạy về cực dương (anot), tại đó xảy ra phản ứng trên các điện cực (sự phóng điện), cụ thể:
- Tại catot xảy ra quá trình khử cation (Mn+ + ne → M) còn tại anot xảy ra quá trình oxi hóa anion (Xn- → X + ne).
II.
 Sự điện phân của các chất điện li
Sự điện phân của các chất điện li

B1: Xác định cation, anion ứng với mỗi điện cực (ion dương di chuyển về cực âm (catot), ion âm di chuyển về cực dương (anot)).
B2: Viết quá trình cho, nhận electron ở mỗi điện cực.
B3: Viết phương trình điện phân.
1. Điện phân chất điện li nóng chảy
VD1: Điện phân nóng chảy NaCl
[TBODY]
[/TBODY]Phương trình điện phân: 2NaCl → 2Na + Cl2
VD2: Điện phân nóng chảy Al2O3 trong criolit (Na3AlF6)
[TBODY]
[/TBODY]Phương trình điện phân: 2Al2O3 → 4Al + 3O2
VD3: Điện phân nóng chảy Ba(OH)2
[TBODY]
[/TBODY]Phương trình điện phân: 2Ba(OH)2 → 2Ba + O2 + 2H2O
2. Điện phân dung dịch chất điện li
a. Quá trình điện phân ở catot: Quá trình khử
- Tại catot có thể xảy ra quá trình khử sau đây:
Mn+ + ne → M
2H+ + 2e → H2
2H2O + 2e → H2 + 2OH-
Trong đó:
- Các ion trước Al trong dãy điện hóa: K+, Na+, Ca2+, Ba2+, Mg2+, Al3+ không tham gia điện phân trong dung dịch, thay vào đó nước sẽ bị điện phân.
- Trong dung dịch có nhiều cation: cation nào có tính oxi hóa mạnh hơn sẽ điện phân trước.

VD: Điện phân dung dịch mà catot chứa các cation sau: Na+, Fe3+, Ag+, H+.
Thứ tự điện phân là:
Ag+ + e → Ag
Fe3+ + e → Fe2+
2H+ + 2e → H2
Fe2+ + 2e → Fe
2H2O + 2e → 2OH- + H2
b. Quá trình điện phân ở anot
- Tại anot xảy ra quá trình oxi hóa anion: Xn- → X + ne
- Gốc axit không chứa oxi như: Cl-, Br-, S2-, … hoặc ion OH- (của bazơ/kiềm) hoặc nước tham gia điện phân.
Trong đó:
- Thứ tự anion bị oxi hóa: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
- Gốc axit có chứa oxi: NO3-, SO42-, CO32-, … không tham gia điện phân, trường hợp này nước sẽ tham gia điện phân: 2H2O → O2 + 4H+ + 4e
VD: Thứ tự điện phân khi anot chứa các: S2-, Cl-, OH- và H2O
S2- → S + 2e
2Cl- → Cl2 + 2e
4OH- → O2 + 2H2O + 2e
2H2O → O2 + 4H+ + 4e
III. Định luật Faraday
Khối lượng chất giải phóng ở mỗi điện cực tỉ lệ với điện lượng đi qua dung dịch và đương lượng của chất
Biểu thức: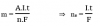
Trong đó:
- M: Khối lượng chất giải phóng ở điện cực (gam)
- A: khối lượng mol nguyên tử của chất thu được ở điện cực
- n: số electrong mà nguyên tử hoặc ion đã cho hoặc nhận
- I: cường độ dòng điện (A)
- t: thời gian điện phân (s)
- F: Hằng số Faraday (F = 1,602.10-19.6,022.1023 = 96500 C.mol-1)
IV. Ứng dụng của điện phân
- Điều chế kim loại
- Điều chế một số phi kim: H2, O2, F2, Cl2
- Điều chế một số hợp chất: nước Gia-ven, NaOH
- Tinh chế kim loại: Cu, Pb, Zn, Ag, Au.
- Mạ điện: Cu, Ag, Au, Cr, Ni
I. Khái niệm
Sự điện phân là quá trình oxi hóa – khử xảy ra ở bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
Sự điện phân là quá trình sử dụng điện năng để tạo ra sự biến đổi hóa học.
Trong quá trình điện phân, dưới tác dụng của điện trường, các cation chạy về cực âm (catot) và các anion chạy về cực dương (anot), tại đó xảy ra phản ứng trên các điện cực (sự phóng điện), cụ thể:
- Tại catot xảy ra quá trình khử cation (Mn+ + ne → M) còn tại anot xảy ra quá trình oxi hóa anion (Xn- → X + ne).
II.

B1: Xác định cation, anion ứng với mỗi điện cực (ion dương di chuyển về cực âm (catot), ion âm di chuyển về cực dương (anot)).
B2: Viết quá trình cho, nhận electron ở mỗi điện cực.
B3: Viết phương trình điện phân.
1. Điện phân chất điện li nóng chảy
VD1: Điện phân nóng chảy NaCl
Catot ( - ) | ← NaCl → | Anot (+) |
Na+ + e → Na | 2Cl- → Cl2 + 2e |
VD2: Điện phân nóng chảy Al2O3 trong criolit (Na3AlF6)
Catot ( - ) | ← Al2O3 → | Anot (+) |
Al3+ + 3e → Al | 2O2- → O2 + 4e |
VD3: Điện phân nóng chảy Ba(OH)2
Catot ( - ) | ← Ba(OH)2 → | Anot (+) |
Ba2+ + 2e → Ba | 4OH- → O2 + 4e + 2H2O |
2. Điện phân dung dịch chất điện li
a. Quá trình điện phân ở catot: Quá trình khử
- Tại catot có thể xảy ra quá trình khử sau đây:
Mn+ + ne → M
2H+ + 2e → H2
2H2O + 2e → H2 + 2OH-
Trong đó:
- Các ion trước Al trong dãy điện hóa: K+, Na+, Ca2+, Ba2+, Mg2+, Al3+ không tham gia điện phân trong dung dịch, thay vào đó nước sẽ bị điện phân.
- Trong dung dịch có nhiều cation: cation nào có tính oxi hóa mạnh hơn sẽ điện phân trước.
VD: Điện phân dung dịch mà catot chứa các cation sau: Na+, Fe3+, Ag+, H+.
Thứ tự điện phân là:
Ag+ + e → Ag
Fe3+ + e → Fe2+
2H+ + 2e → H2
Fe2+ + 2e → Fe
2H2O + 2e → 2OH- + H2
b. Quá trình điện phân ở anot
- Tại anot xảy ra quá trình oxi hóa anion: Xn- → X + ne
- Gốc axit không chứa oxi như: Cl-, Br-, S2-, … hoặc ion OH- (của bazơ/kiềm) hoặc nước tham gia điện phân.
Trong đó:
- Thứ tự anion bị oxi hóa: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
- Gốc axit có chứa oxi: NO3-, SO42-, CO32-, … không tham gia điện phân, trường hợp này nước sẽ tham gia điện phân: 2H2O → O2 + 4H+ + 4e
VD: Thứ tự điện phân khi anot chứa các: S2-, Cl-, OH- và H2O
S2- → S + 2e
2Cl- → Cl2 + 2e
4OH- → O2 + 2H2O + 2e
2H2O → O2 + 4H+ + 4e
III. Định luật Faraday
Khối lượng chất giải phóng ở mỗi điện cực tỉ lệ với điện lượng đi qua dung dịch và đương lượng của chất
Biểu thức:
Trong đó:
- M: Khối lượng chất giải phóng ở điện cực (gam)
- A: khối lượng mol nguyên tử của chất thu được ở điện cực
- n: số electrong mà nguyên tử hoặc ion đã cho hoặc nhận
- I: cường độ dòng điện (A)
- t: thời gian điện phân (s)
- F: Hằng số Faraday (F = 1,602.10-19.6,022.1023 = 96500 C.mol-1)
IV. Ứng dụng của điện phân
- Điều chế kim loại
- Điều chế một số phi kim: H2, O2, F2, Cl2
- Điều chế một số hợp chất: nước Gia-ven, NaOH
- Tinh chế kim loại: Cu, Pb, Zn, Ag, Au.
- Mạ điện: Cu, Ag, Au, Cr, Ni

