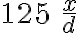Câu 25:
Sau phản ứng thu được 0,6m gam kim loại nên muối thu được là muối Fe+2
3Fe + 8H+ + 2NO3- → 3Fe+2 + 2NO + 4H2O
0,15----0,4---0,1---------------------0,1
Vì sau phản ứng thu được hỗn hợp kim loại nên Fe còn dư
Fe + Cu+2 → Fe+2 + Cu
0,16--0,16--------------0,16
Vậy khối lượng chất rắn sau phản ứng gồm Fe dư và Cu
0,6m = m - 17,36 + 10,24 => m = 17,8 gam
Câu 31:
mO(A) = mA-mFe = x gam => nO(A) = x/16 mol
Áp dụng ĐLBT điện tích: nCl-= 2nO(A) = x/8
=>mddHCl = x/8*36,5*100/3,65=125x => VddHCl =
Câu 32:
mFe :mCu = 3 : 7 => mFe= 0,3m, mCu = 0,7m.
Khối lượng hỗn hợp X giảm: m-0,75m = 0,25m => Fe còn dư, Cu chưa phản ứng.
mFe phản ứng = 0,25m => nFe phản ứng = m/224
nHNO3 = 0,7 mol, nZ = 0,25 mol
Áp dụng ĐLBT nguyên tố: nHNO3 = 2nFe(NO3)2 + nNO + nNO2
<=>0,7 = 2m/224 + 0,25 => m = 50,4 g.
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.