 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chào mừng các thành viên xinh đẹp, dễ thương của HMF đã đến với một chủ đề hoàn toàn mới lạ của box hóa chúng mình 
Các 2k7 ơi dù đã bước vào năm học mới rồi nhưng chắc các bạn cũng gặp không ít rắc rối với chương trình mới đặc biệt là hóa học phải không ?
Tuy nội dung khá sát với sách cũ, thế nhưng tại chương trình mới này lại có những chủ đề tương đối mới lạ và hầu như các bạn chưa từng nhìn thấy.
Thế nhưng không sao cả, đó cũng chính là lý do có bài viết này ở đây với mục đích chia sẽ những kiến thức mình tìm hiểu được về chương trình mới này, mọi người cố lên nhé.
Đây cũng là topic đầu tay của mình mong mọi người ủng hộ
Bây giờ thì .......bắt đầu thôi !
A.Phản ứng hóa học và Enthalpy
I. Phản ứng hóa học
Ở chương trình THCS ta đã được biết phản ứng hóa học là gì? Thế nhưng các bạn có biết ngoài các chất sản phẩm ra thì phản ứng hóa học còn kèm theo những gì không? Vấn đề trên sẽ được giải quyết qua bài viết ngày hôm nay.
Ở chương trình THPT thì ngoài sản phẩm ra thì trong quá trình phản ứng thì luôn kèm theo sự giải phóng hoặc hấp thụ năng lượng. Năng lượng này được gọi là năng lượng hóa học (năng lượng được đề cập trong chương trình học là năng lượng dưới dạng nhiệt)
Lúc này:
-Các phản ứng giải phóng năng lượng dưới dạng nhiệt gọi là phản ứng tỏa nhiệt
-Các phản ứng hấp thụ năng lượng dưới dạng nhiệt gọi là phản ứng thu nhiệt
Ví dụ về các phản ứng kèm theo sự thay đổi năng lượng: Phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, phản ứng nung vôi, nung clinker xi măng,..
*Lưu ý: Với cùng một phản ứng, ở điều kiện khác nhau về nhiệt độ, áp suất thì lượng nhiệt kèm theo cũng khác nhau.
~> Để thuận tiện cho việc so sánh lượng nhiệt kèm theo, người ta sử dụng điều kiện chuẩn và quy định như sau: Diều kiện chuẩn ứng với áp suất 1 bar ≈ 0,99 atm (đối với chất khí), nồng độ 1 [imath]mol L^{-1}[/imath] (đối với chất tan trong dung dịch) và nhiệt thường được chọn là 298 K ([imath]25 ^oC[/imath]) ([imath]K = 273 + ^oC[/imath])
II. Enthalpy
1.Enthalpy tạo thành chuẩn của một chất hóa học
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất, kí hiệu là [imath]\Delta_fH_{298}^0[/imath], à lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chát đó từ các đơn chất ở dạng bền vững ( điều kiện chuẩn) ([imath]kJ mol^{-1}[/imath])
Ví dụ :
[imath]2Na(s) + \frac{1}{2}O_2(g) \to Na_2O(s)[/imath] [imath]\Delta_fH_{298}^0=-418,0 kJ mol^{-1}[/imath]
Ta nói: Ở điều kiện chuẩn, phản ứng giữa 2 mol Na( thể rắn) với [imath]\frac{1}{2}[/imath] mol [imath]O_2[/imath] (thể khí) thu được 1 mol [imath]Na_2O[/imath] (thể rắn) và giải phóng 418,0 kJ nhiệt
Với :
[imath]\Delta_fH_{298}^0[/imath] < 0 thì phản ứng là phản ứng tỏa nhiệt
[imath]\Delta_fH_{298}^0[/imath] >0 thì phản ứng là phản ứng thu nhiệt
* Enthalpy tạo thành chuẩn của đơn chất dạng bền nhất đều bằng 0 ( VD: [imath]H_2[/imath], [imath]N_2[/imath], [imath]I_2[/imath], [imath]O_2[/imath],.. [imath]\Delta_fH_{298}^0[/imath]=0 )
Ví dụ :
[imath]2Na (s) + \frac{1}{2}O_2 (g) \to Na_2O (s)[/imath] [imath]\Delta_fH_{298}^0[/imath]=[imath]-418,0 kJ mol^{-1}[/imath]
[imath]\Delta_fH_{298}^0[/imath]< 0 => phản ứng tỏa nhiệt
[imath]\frac{1}{2} H_2 (g)+ \frac{1}{2}I_2 (s) \to HI (g)[/imath] [imath]\Delta_fH_{298}^0[/imath]=[imath]26,5 kJ mol^-[/imath]
[imath]\Delta_fH_{298}^0[/imath]> 0=> phản ứng thu nhiệt
Ta có một số enthalpy tạo thành chuẩn một số chất như sau:
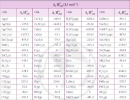
*Các bạn có thể xem thêm SGK để biết thêm một số Enthalpy tạo thành chuẩn của các chất ( phụ lục 3 Hóa học 10-Cánh diều trang 117 )
*Lưu ý: Cần viết rõ trạng thái của chất
2. Biến thiên enthalpy chuẩn của phản ứng hóa học
Trong trường hợp chung, các chất phản ứng có thể là đơn chất, hợp chất. Một cách tổng quát, nhiệt kèm theo của một phản ứng hóa học ở áp suất không đổi ( nhiệt độ xác định ) gọi là biến thiên enthalpy
Biến thiên enthalpy chuẩn của một phản ứng hóa học kí hiệu là [imath]\Delta_rH_{298}^0[/imath] chính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng ở điều kiện chuẩn. (kJ)
Ví dụ :
[imath]CH_4 (g) + 2O_2 (g) \to CO_2 (g) + 2H_2O (l)[/imath] [imath]\Delta_rH_{298}^0=-890,5 kJ[/imath]
Ta nói: khi đốt cháy 1 mol [imath]CH_4[/imath] ở điều kiện chuẩn, sản phẩm là [imath]CO_2[/imath](g) và [imath]H_2O[/imath](l), sẽ giải phóng một nhiệt lượng là 890,5 kJ
* Lưu ý: cần phân biệt rõ khi nào là enthalpy tạo thành chuẩn của một chất với biến thiên enthalpy của phản ứng để tránh nhầm lẫn khi làm bài tập nhé !
Ví dụ :
[imath]CaCO_3(s) \to CaO(s) + CO_2 (g)[/imath] [imath]\Delta_rH_{298}^0=179,2 kJ[/imath]
[imath]\Delta_rH_{298}^0[/imath] > 0 => Phản ứng thu nhiệt
[imath]NaOH(aq) + HCl(aq) \to NaCl(aq) + H_2O(l)[/imath] [imath]\Delta_rH_{298}^0=-57,9 kJ[/imath]
[imath]\Delta_rH_{298}^0[/imath] < 0 => Phản ứng tỏa nhiệt
*Lưu ý: Cần viết rõ trạng thái của chất khi viết phản ứng kèm theo giá trị [imath]\Delta_rH_{298}^0[/imath], ở mỗi trạng thái của chất thì có thể làm khác đi giá trị của [imath]\Delta_rH_{298}^0[/imath]
Với: g (gas): chất khí, s (solid): chất rắn, aq ( aquecous): chất tan trong nước, l (liquid): chất lỏng
Tương tự như enthalpy tạo thành chuẩn của một chất thì dựa vào biến thiên enthalpy của phản ứng ta cũng có thể xác định được loại phản ứng:
[imath]\Delta_rH_{298}^0[/imath] < 0 thì phản ứng là phản ứng tỏa nhiệt
[imath]\Delta_rH_{298}^0[/imath] > 0 thì phản ứng là phản ứng thu nhiệt
Câu hỏi luyện tập
Câu 1:
Hãy nêu một số phản ứng kèm theo sự thay đổi năng lượng và cho biết chúng thuôc loại phản ứng tỏa nhiệt hay thu nhiệt ?
Câu 2:
Cho biết giá trị [imath]\Delta_fH_{298}^0[/imath] của [imath]O_2[/imath] là bao nhiêu ?
A. [imath]0 kJ mol^{-1}[/imath]
B. [imath]26,5 kJ mol^{-1}[/imath]
C. [imath]-418,0 kJ mol^{-1}[/imath]
D. Đáp án khác
Câu 3:
Cho phản ứng sau: [imath]CH_4 (g) + 2O_2 (g) \to CO_2 (g) + 2H_2O(l)[/imath] có [imath]\Delta_rH_{298}^0[/imath] < 0 xảy ra trong bìn kín. Hỏi khi phản ứng kết thúc thì nhiệt độ của bình tăng hay giảm? Tại sao?
Câu 4:
Cho phản ứng sau: [imath]H_2 (g)+ Cl_2(g) \to 2HCl(g)[/imath]. Hỏi sản phẩm tạo thành có [imath]\Delta_fH_{298}^0[/imath] là bao nhiêu? Và phản ứng trên thuộc loại phản ứng gì?
Câu 5:
Cho phản ứng : [imath]2NaCl(s) \to 2Na(s) + Cl_2(g)[/imath] [imath]\Delta_rH_{298}^0 = 822,4 kJ[/imath]
Phản ứng trên cho biết gì ?
*Phần đầu tiên đến đây là hết rồi phần tiếp theo chúng ta sẽ tiếp tục tìm hiểu về ý nghĩa và cách tính biến thiên Enthalpy của phản ứng, các bạn cùng đón chờ phần tiếp theo nhé !
________________________________________________________________________________
Bạn nào có lời giải hay đóng góp ý kiến thì trả lời vào bên dưới nhé !Mình sẽ cập nhật đáp án sau nhé, phần tiếp theo của chủ đề vào 18:00 ngày chủ nhật (11/9) nhé !
Bye bye và hẹn gặp lại các bạn, chúc các bạn học tốt !

Các 2k7 ơi dù đã bước vào năm học mới rồi nhưng chắc các bạn cũng gặp không ít rắc rối với chương trình mới đặc biệt là hóa học phải không ?

Tuy nội dung khá sát với sách cũ, thế nhưng tại chương trình mới này lại có những chủ đề tương đối mới lạ và hầu như các bạn chưa từng nhìn thấy.

Thế nhưng không sao cả, đó cũng chính là lý do có bài viết này ở đây với mục đích chia sẽ những kiến thức mình tìm hiểu được về chương trình mới này, mọi người cố lên nhé.

Đây cũng là topic đầu tay của mình mong mọi người ủng hộ

Bây giờ thì .......bắt đầu thôi !
Chủ đề : Năng lượng hóa học
(Tuy rất muốn gộp chung các chủ đề nhưng do dài quá mình xin phép được chia chủ đề thành 2 phần theo SGK nhé, mong mọi người thông cảm )
)
( bài viết này dựa trên quyển Hóa học 10- Cánh diều nên sẽ có thể có một số điểm khác với các bộ sách khác )
(Tuy rất muốn gộp chung các chủ đề nhưng do dài quá mình xin phép được chia chủ đề thành 2 phần theo SGK nhé, mong mọi người thông cảm
 )
)( bài viết này dựa trên quyển Hóa học 10- Cánh diều nên sẽ có thể có một số điểm khác với các bộ sách khác )
A.Phản ứng hóa học và Enthalpy
I. Phản ứng hóa học
Ở chương trình THCS ta đã được biết phản ứng hóa học là gì? Thế nhưng các bạn có biết ngoài các chất sản phẩm ra thì phản ứng hóa học còn kèm theo những gì không? Vấn đề trên sẽ được giải quyết qua bài viết ngày hôm nay.
Ở chương trình THPT thì ngoài sản phẩm ra thì trong quá trình phản ứng thì luôn kèm theo sự giải phóng hoặc hấp thụ năng lượng. Năng lượng này được gọi là năng lượng hóa học (năng lượng được đề cập trong chương trình học là năng lượng dưới dạng nhiệt)
Lúc này:
-Các phản ứng giải phóng năng lượng dưới dạng nhiệt gọi là phản ứng tỏa nhiệt
-Các phản ứng hấp thụ năng lượng dưới dạng nhiệt gọi là phản ứng thu nhiệt
Ví dụ về các phản ứng kèm theo sự thay đổi năng lượng: Phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, phản ứng nung vôi, nung clinker xi măng,..
*Lưu ý: Với cùng một phản ứng, ở điều kiện khác nhau về nhiệt độ, áp suất thì lượng nhiệt kèm theo cũng khác nhau.
~> Để thuận tiện cho việc so sánh lượng nhiệt kèm theo, người ta sử dụng điều kiện chuẩn và quy định như sau: Diều kiện chuẩn ứng với áp suất 1 bar ≈ 0,99 atm (đối với chất khí), nồng độ 1 [imath]mol L^{-1}[/imath] (đối với chất tan trong dung dịch) và nhiệt thường được chọn là 298 K ([imath]25 ^oC[/imath]) ([imath]K = 273 + ^oC[/imath])
II. Enthalpy
1.Enthalpy tạo thành chuẩn của một chất hóa học
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất, kí hiệu là [imath]\Delta_fH_{298}^0[/imath], à lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chát đó từ các đơn chất ở dạng bền vững ( điều kiện chuẩn) ([imath]kJ mol^{-1}[/imath])
Ví dụ :
[imath]2Na(s) + \frac{1}{2}O_2(g) \to Na_2O(s)[/imath] [imath]\Delta_fH_{298}^0=-418,0 kJ mol^{-1}[/imath]
Ta nói: Ở điều kiện chuẩn, phản ứng giữa 2 mol Na( thể rắn) với [imath]\frac{1}{2}[/imath] mol [imath]O_2[/imath] (thể khí) thu được 1 mol [imath]Na_2O[/imath] (thể rắn) và giải phóng 418,0 kJ nhiệt
Với :
[imath]\Delta_fH_{298}^0[/imath] < 0 thì phản ứng là phản ứng tỏa nhiệt
[imath]\Delta_fH_{298}^0[/imath] >0 thì phản ứng là phản ứng thu nhiệt
* Enthalpy tạo thành chuẩn của đơn chất dạng bền nhất đều bằng 0 ( VD: [imath]H_2[/imath], [imath]N_2[/imath], [imath]I_2[/imath], [imath]O_2[/imath],.. [imath]\Delta_fH_{298}^0[/imath]=0 )
Ví dụ :
[imath]2Na (s) + \frac{1}{2}O_2 (g) \to Na_2O (s)[/imath] [imath]\Delta_fH_{298}^0[/imath]=[imath]-418,0 kJ mol^{-1}[/imath]
[imath]\Delta_fH_{298}^0[/imath]< 0 => phản ứng tỏa nhiệt
[imath]\frac{1}{2} H_2 (g)+ \frac{1}{2}I_2 (s) \to HI (g)[/imath] [imath]\Delta_fH_{298}^0[/imath]=[imath]26,5 kJ mol^-[/imath]
[imath]\Delta_fH_{298}^0[/imath]> 0=> phản ứng thu nhiệt
Ta có một số enthalpy tạo thành chuẩn một số chất như sau:

*Các bạn có thể xem thêm SGK để biết thêm một số Enthalpy tạo thành chuẩn của các chất ( phụ lục 3 Hóa học 10-Cánh diều trang 117 )
*Lưu ý: Cần viết rõ trạng thái của chất
2. Biến thiên enthalpy chuẩn của phản ứng hóa học
Trong trường hợp chung, các chất phản ứng có thể là đơn chất, hợp chất. Một cách tổng quát, nhiệt kèm theo của một phản ứng hóa học ở áp suất không đổi ( nhiệt độ xác định ) gọi là biến thiên enthalpy
Biến thiên enthalpy chuẩn của một phản ứng hóa học kí hiệu là [imath]\Delta_rH_{298}^0[/imath] chính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng ở điều kiện chuẩn. (kJ)
Ví dụ :
[imath]CH_4 (g) + 2O_2 (g) \to CO_2 (g) + 2H_2O (l)[/imath] [imath]\Delta_rH_{298}^0=-890,5 kJ[/imath]
Ta nói: khi đốt cháy 1 mol [imath]CH_4[/imath] ở điều kiện chuẩn, sản phẩm là [imath]CO_2[/imath](g) và [imath]H_2O[/imath](l), sẽ giải phóng một nhiệt lượng là 890,5 kJ
* Lưu ý: cần phân biệt rõ khi nào là enthalpy tạo thành chuẩn của một chất với biến thiên enthalpy của phản ứng để tránh nhầm lẫn khi làm bài tập nhé !
Ví dụ :
[imath]CaCO_3(s) \to CaO(s) + CO_2 (g)[/imath] [imath]\Delta_rH_{298}^0=179,2 kJ[/imath]
[imath]\Delta_rH_{298}^0[/imath] > 0 => Phản ứng thu nhiệt
[imath]NaOH(aq) + HCl(aq) \to NaCl(aq) + H_2O(l)[/imath] [imath]\Delta_rH_{298}^0=-57,9 kJ[/imath]
[imath]\Delta_rH_{298}^0[/imath] < 0 => Phản ứng tỏa nhiệt
*Lưu ý: Cần viết rõ trạng thái của chất khi viết phản ứng kèm theo giá trị [imath]\Delta_rH_{298}^0[/imath], ở mỗi trạng thái của chất thì có thể làm khác đi giá trị của [imath]\Delta_rH_{298}^0[/imath]
Với: g (gas): chất khí, s (solid): chất rắn, aq ( aquecous): chất tan trong nước, l (liquid): chất lỏng
Tương tự như enthalpy tạo thành chuẩn của một chất thì dựa vào biến thiên enthalpy của phản ứng ta cũng có thể xác định được loại phản ứng:
[imath]\Delta_rH_{298}^0[/imath] < 0 thì phản ứng là phản ứng tỏa nhiệt
[imath]\Delta_rH_{298}^0[/imath] > 0 thì phản ứng là phản ứng thu nhiệt
Câu hỏi luyện tập
Câu 1:
Hãy nêu một số phản ứng kèm theo sự thay đổi năng lượng và cho biết chúng thuôc loại phản ứng tỏa nhiệt hay thu nhiệt ?
Câu 2:
Cho biết giá trị [imath]\Delta_fH_{298}^0[/imath] của [imath]O_2[/imath] là bao nhiêu ?
A. [imath]0 kJ mol^{-1}[/imath]
B. [imath]26,5 kJ mol^{-1}[/imath]
C. [imath]-418,0 kJ mol^{-1}[/imath]
D. Đáp án khác
Câu 3:
Cho phản ứng sau: [imath]CH_4 (g) + 2O_2 (g) \to CO_2 (g) + 2H_2O(l)[/imath] có [imath]\Delta_rH_{298}^0[/imath] < 0 xảy ra trong bìn kín. Hỏi khi phản ứng kết thúc thì nhiệt độ của bình tăng hay giảm? Tại sao?
Câu 4:
Cho phản ứng sau: [imath]H_2 (g)+ Cl_2(g) \to 2HCl(g)[/imath]. Hỏi sản phẩm tạo thành có [imath]\Delta_fH_{298}^0[/imath] là bao nhiêu? Và phản ứng trên thuộc loại phản ứng gì?
Câu 5:
Cho phản ứng : [imath]2NaCl(s) \to 2Na(s) + Cl_2(g)[/imath] [imath]\Delta_rH_{298}^0 = 822,4 kJ[/imath]
Phản ứng trên cho biết gì ?
*Phần đầu tiên đến đây là hết rồi phần tiếp theo chúng ta sẽ tiếp tục tìm hiểu về ý nghĩa và cách tính biến thiên Enthalpy của phản ứng, các bạn cùng đón chờ phần tiếp theo nhé !
________________________________________________________________________________
Bạn nào có lời giải hay đóng góp ý kiến thì trả lời vào bên dưới nhé !Mình sẽ cập nhật đáp án sau nhé, phần tiếp theo của chủ đề vào 18:00 ngày chủ nhật (11/9) nhé !

Bye bye và hẹn gặp lại các bạn, chúc các bạn học tốt !

Last edited:















 chờ bài đăng của bạn cho các nội dung tiếp theo nhé
chờ bài đăng của bạn cho các nội dung tiếp theo nhé (mong idol sẽ đăng bài phần động hoá học)
(mong idol sẽ đăng bài phần động hoá học)