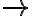J
jojokensin
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Ở đây CaCo3 kết tủa mà, làm sao phản ứng được nhỉ?Phương trình ion rút gọn của phản ứng giữa dung dịch HCl và CaCO3 là
- H+ + OH -
H2O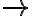
- 2H+ + CaCO3
Ca2+ + CO2 + H2O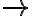
- 2H+ + CO32-
CO2 + H2O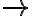
- Cl - + Na+
NaCl