 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
1. Phương pháp nguyên tử nguyên tố
Đây là một phương pháp khá đơn giản. Khi cân bằng ta cố ý viết các đơn chất khí (H2, O2, C12, N2…) dưới dạng nguyên tử riêng biệt rồi lập luận qua một số bước.
Ví dụ: Cân bằng phản ứng P + O2 –> P2O5
Ta viết: P + O –> P2O5
Để tạo thành 1 phân tử P2O5 cần 2 nguyên tử P và 5 nguyên tử O:
2P + 5O –> P2O5
Nhưng phân tử oxi bao giờ cũng gồm hai nguyên tử, như vậy nếu lấy 5 phân tử oxi tức là số nguyên tử oxi tăng lên gấp 2 thì số nguyên tử P và số phân tử P2O5 cũng tăng lên gấp 2, tức 4 nguyên tử P và 2 phân tử P2O5.
Do đó: 4P + 5O2 –> 2P2O5
2. Phương pháp hóa trị tác dụng
Hóa trị tác dụng là hóa trị của nhóm nguyên tử hay nguyên tử của các nguyên tố trong chất tham gia và tạo thành trong PUHH.
Áp dụng phương pháp này cần tiến hành các bước sau:
+ Xác định hóa trị tác dụng:
II – I III – II II-II III – I
BaCl2 + Fe2(SO4)3 –> BaSO4 + FeCl3
Hóa trị tác dụng lần lượt từ trái qua phải là:
II – I – III – II – II – II – III – I
Tìm bội số chung nhỏ nhất của các hóa trị tác dụng:
BSCNN(1, 2, 3) = 6
+ Lấy BSCNN chia cho các hóa trị ta được các hệ số:
6/II = 3, 6/III = 2, 6/I = 6
Thay vào phản ứng:
3BaCl2 + Fe2(SO4)3 –> 3BaSO4 + 2FeCl3
3. Phương pháp “chẵn – lẻ”
Một phản ứng sau khi đã cân bằng thì số nguyên tử của một nguyên tố ở vế trái bằng số nguyên tử nguyên tố đó ở vế phải. Vì vậy nếu số nguyên tử của một nguyên tố ở một vế là số chẵn thì số nguyên tử nguyên tố đó ở vế kia phải chẵn. Nếu ở một công thức nào đó số nguyên tử nguyên tố đó còn lẻ thì phải nhân đôi.
Ví dụ: FeS2 + O2 –> Fe2O3 + SO2
Ở vế trái số nguyên tử O2 là chẵn với bất kỳ hệ số nào. Ở vế phải, trong SO2 oxi là chẵn nhưng trong Fe2O3 oxi là lẻ nên phải nhân đôi. Từ đó cân bằng tiếp các hệ số còn lại.
2Fe2O3 –> 4FeS2 –> 8SO2 + 11O2
Đó là thứ tự suy ra các hệ số của các chất. Thay vào PTPU ta được:
4FeS2 + 11O2 –> 2Fe2O3 + 8SO2
4: phương pháp cân bằng electron
Nguyên tắc: dựa vào sự bảo toàn electron nghĩa là tổng số electron của chất khử cho phải bằng tổng số electron chất oxi hóa nhận.
Các bước cân bằng:
Bước 1: Viết sơ đồ phản ứng với các nguyên tố có sự thay đổi số oxi hóa.
Bước 2: Viết các quá trình: khử (cho electron), oxi hóa (nhận electron).
Bước 3:Cân bằng electron: nhân hệ số để:
Tổng số electron cho = tổng số electron nhận.
(tổng số oxi hóa giảm = tổng số oxi hóa tăng).
Bước 4: Cân bằng nguyên tố không thay đổi số oxi hoá (thường theo thứ tự:
kim loại (ion dương):
gốc axit (ion âm).
môi trường (axit, bazơ).
nước (cân bằng H2O để cân bằng hiđro).
Bước 5: Kiểm soát số nguyên tử oxi ở 2 vế (phải bằng nhau).
Lưu ý:
Khi viết các quá trình oxi hoá và quá trình khử của từng nguyên tố, cần theo đúng chỉ số qui định của nguyên tố đó.
Ví dụ:
Fe + H2SO4đặc nóng → Fe2(SO4)3 + SO2 + H2O
Fe0 → Fe+3 + 3e
1 x 2Fe0 → 2Fe+3 + 6e
3 x S+6 + 2e → S+4
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H20
5,: phương pháp cân bằng ion – electron:
Phạm vi áp dụng: đối với các quá trình xảy ra trong dung dịch, có sự tham gia của môi trường (H2O, dung dịch axit hoặc bazơ tham gia).
Các nguyên tắc:
•Nếu phản ứng có axit tham gia: vế nào thừa O phải thêm H+ để tạo H2O và ngược lại.
•Nếu phản ứng có bazơ tham gia: vế nào thừa O phải thêm H2O để tạo ra OH-
Các bước tiến hành:
Bước 1: Tách ion, xác định các nguyên tố có số oxi hóa thay đổi và viết các nửa phản ứng oxi hóa – khử.
Bước 2: Cân bằng các bán phản ứng:
Cân bằng số nguyên tử mỗi nguyên tố ở hai vế:
Thêm H+ hay OH-
Thêm H2O để cân bằng số nguyên tử hiđro
Kiểm soát số nguyên tử oxi ở 2 vế (phải bằng nhau).
Cân bằng điện tích: thêm electron vào mỗi nửa phản ứng để cân bằng điện tích
Bước 3: Cân bằng electron: nhân hệ số để:
Tổng số electron cho = tổng số electron nhận.
(tổng số oxi hóa giảm = tổng số oxi hóa tăng).
Bước 4: Cộng các nửa phản ứng ta có phương trình ion thu gọn.
Bước 5: Để chuyển phương trình dạng ion thu gọn thành phương trình ion đầy đủ và phương trình phân tử cần cộng vào 2 vế những lượng bằng nhau các cation hoặc anion để bù trừ điện tích.
Ví dụ: Cân bằng phương trình phản ứng:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
Bước 1: Cu + H+ + NO3- → Cu2+ + 2NO3- + NO + H2O
Cu0 → Cu2+
NO3-→ NO
Bước 2: Cân bằng nguyên tố:
Cu → Cu2+
NO3- + 4H+ → NO + 2H2O
Cân bằng điện tích
Cu → Cu2+ + 2e
NO3- + 4H+ + 3e → NO + 2H2O
Bước 3: Cân bằng electron:
3 x Cu → Cu2+ + 2e
2 x NO3- + 4H+ + 3e → NO + 2H2O
Bước 4: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2O
Bước 5: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
Nội dung 3: Các dạng phản ứng oxi hóa khử phức tạp
1. Phản ứng oxi hoá khử có hệ số bằng chữ
Nguyên tắc:
Cần xác định đúng sự tăng giảm số oxi hoá của các nguyên tố
Ví dụ:
Fe3O4 + HNO3→ Fe(NO3)3 + NxOy + H20
(5x – 2y) x 3Fe+8/3 → 3Fe+9/3 + e
1 x xN+5 + (5x – 2y)e → xN+2y/x
(5x-2y)Fe3O4+ (46x-18y)HNO3 → (15x-6y)Fe(NO3)3+NxOy+(23x-9y)H2O
2. Phản ứng có chất hh là tổ hợp của 2 chất khử
Nguyên tắc :
Cách 1 : Viết mọi phương trình biểu diễn sự thay đổi số oxi hoá, chú ý sự ràng buộc hệ số ở hai vế của phản ứng và ràng buộc hệ số trong cùng phân tử.
Cách 2 : Nếu một phân tử có nhiều nguyên tố thay đổi số oxi hoá có thể xét chuyển nhóm hoặc toàn bộ phân tử, đồng thời chú ý sự ràng buộc ở vế sau.
Luyện tập: Cân bằng phản ứng sau :
FeS2 + O2 → Fe2O3 + SO2
Fe+2 → Fe+3 + 1e
2S-1 → 2S+4 + 2.5e
4 x FeS2 → Fe+3 +2S+4 + 11e
11 x 2O0 + 4e → 2O
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3. Phản ứng có nguyên tố tăng hay giảm số oxi hoá ở nhiều nấc
oNguyên tắc :
• Cách 1 : Viết mọi phương trình thay đổi số oxi hoá, đặt ẩn số cho từng nấc tăng, giảm số oxi hoá.
•Cách 2 : Tách ra thành hai hay nhiều phương trình ứng với từng nấc số oxi hóa tăng hay giảm.
Ví dụ: Cân bằng phản ứng sau:
Al + HNO3→ Al(NO3)3 + NO + N2O + H2O
Cách 1: (3x + 8y) x Al0→ Al+3 + 3e
3 x xN+5 + 3xe → xN+5
3 x 2yN+5 + 8ye → 2yN+1
(3x+8y)Al +(12x+30y)HNO3→(3x+8y)Al(NO3)3+3xNO+3yNO2+(6x+15 y)H2O
Cách 2: Tách thành 2 phương trình :
a x Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
b x 8Al + 30 HNO3 → 8Al(NO3)3 +3N2O + 15H2O
(a+8b)Al + (4a+30b)HNO3 → (a+8b)Al(NO3)3 + a NO + 3b N2O+(2a+15b)H2O
4. Phản ứng không xác định rõ môi trường
oNguyên tắc:
•Có thể cân bằng nguyên tố bằng phương pháp đại số hoặc qua trung gian phương trình ion thu gọn.
•Nếu do gom nhiều phản ứng vào, cần phân tích để xác định giai đoạn nào là oxi hóa khử.
Ví dụ: Al + H2O + NaOH → NaAlO2 + H2
Al + H20 → Al(OH)3 + H2
2 x Al0 → Al+3 + 3e
3 x 2H+ + 2e → H2
2Al + 6H20 → 2Al(OH)3 + H2 (1)
2Al(OH)3 + 2NaOH → 2NaAlO2 + 4H20 (2)
Tổng hợp 2 phương trình trên:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Một số bài tập :
Bài 1
Cân bằng các PTHH sau :
1) MgCl2 + KOH → Mg(OH)2 + KCl
2) Cu(OH)2 + HCl → CuCl2 + H2O
3) Cu(OH)2 + H2SO4 → CuSO4 + H2O
4) FeO + HCl → FeCl2 + H2O
5) Fe2O3 + H2SO4 → Fe2 (SO4)3 + H2O
6) Cu(NO3)2 + NaOH → Cu(OH)2 + NaNO3
7) P + O2 → P2O5
8) N2 + O2 → NO
9) NO + O2 → NO2
10) NO2 + O2 + H2O → HNO3
11) SO2 + O2 → SO3
12) N2O5 + H2O → HNO3
13) Al2(SO4)3 + AgNO3 → Al(NO3)3 + Ag2SO4
14) Al2 (SO4)3 + NaOH → Al(OH)3 + Na2SO4
15) CaO + CO2 → CaCO3
16) CaO + H2O → Ca(OH)2
17) CaCO3 + H2O + CO2 → Ca(HCO3)2
18) Na + H3PO4 → Na2HPO4 + H2
19) Na + H3PO4 → Na3PO4 + H2
20) Na + H3PO4 → NaH2PO4 + H2
21) C2H2 + O2 → CO2 + H2O
22) C4H10 + O2 → CO2 + H2O
23) C2H2 + Br2 → C2H2Br4
24) C6H5OH + Na → C6H5ONa + H2
25) CH3COOH+ Na2CO3 → CH3COONa + H2O + CO2
26) CH3COOH + NaOH → CH3COONa + H2O
27) Ca(OH)2 + HBr → CaBr2 + H2O
28) Ca(OH)2 + HCl → CaCl2 + H2O
29) Ca(OH)2 + H2SO4 → CaSO4 + H2O
30) Ca(OH)2 + Na2CO3 → CaCO3 + NaOH
31) Na2S + H2SO4 → Na2SO4 + H2S
32) Na2S + HCl → NaCl + H2S
33) K3PO4 + Mg(OH)2 → KOH + Mg3 (PO4)2
34) Mg + HCl → MgCl2 + H2
35) Fe + H2SO4 → FeSO4 + H2
36) Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
37) Al(OH)3 + HCl → AlCl3 + H2O
38) KMnO4 → K2MnO4 + MnO2 + O2
39) MnO2 + HCl → MnCl2 + Cl2 + H2O
40) KNO3 → KNO2 + O2
41) Ba(NO3)2 + H2SO4 → BaSO4 + HNO3
42) Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
43) AlCl3 + NaOH → Al(OH)3 + NaCl
44) Al(OH)3 + NaOH → NaAlO2 + H2O
45) KClO3 → KCl + O2
45) Fe(NO3)3 + KOH → Fe(OH)3 + KNO3
46) H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2
47) HCl + CaCO3 → CaCl2 + H2O + CO2
48) Ba(OH)2 + HCl → BaCl2 + H2O
49) BaO + HBr → BaBr2 + H2O
50) Fe + O2 → Fe3O4
Bài 2 (*)
Lập phương trình hóa học của các phản ứng sau:
1) CnH2n + O2 → CO2 + H2O
2) CnH2n + 2 + O2 → CO2 + H2O
3) CnH2n - 2 + O2 → CO2 + H2O
4) CnH2n - 6 + O2 → CO2 + H2O
5) CnH2n + 2O + O2 → CO2 + H2O
6) CxHy + O2 → CO2 + H2O
7) CxHyOz + O2 → CO2 + H2O
8) CxHyOzNt + O2 → CO2 + H2O + N2
9) CHx + O2 → COy + H2O
10) FeClx + Cl2 → FeCl3
Bài 3
Cho sơ đồ của các phản ứng sau:
a) Na + O2 → Na2O b) P2O5 + H2O → H3PO4
c) HgO → Hg + O2 d) Fe(OH)3 → Fe2O3 + H2O
Lập PTHH và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
Lời giải tham khảo:
Bài 1.
1) MgCl2 + 2KOH → Mg(OH)2 + 2KCl
2) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
3) Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
4) FeO + 2HCl → FeCl2 + H2O
5) Fe2O3 + 3H2SO4 → Fe2 (SO4)3 + 3H2O
6) Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
7) 4P + 5O2 → 2P2O5
8) N2 + O2 → 2NO
9) 2NO + O2 → 2NO2
10) 4NO2 + O2 + 2H2O → 4HNO3
11) 2SO2 + O2 → 2SO3
12) N2O5 + H2O → 2HNO3
13) Al2(SO4)3 + 6AgNO3 → 2Al(NO3)3 + 3Ag2SO4
14) Al2 (SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
15) CaO + CO2 → CaCO3
16) CaO + H2O → Ca(OH)2
17) CaCO3 + H2O + CO2 → Ca(HCO3)2
18) 2Na + H3PO4 → Na2HPO4 + H2
19) 6Na + 2H3PO4 → 2Na3PO4 + 3H2
20) 2Na + 2H3PO4 → 2NaH2PO4 + H2
21) 2C2H2 + 5O2 → 4CO2 + 2H2O
22) 2C4H10 + 13O2 → 8CO2 + 10H2O
23) C2H2 + 2Br2 → C2H2Br4
24) 2 C6H5OH + 2Na → 2C6H5ONa + H2
25) CH3COOH+ Na2CO3 → CH3COONa + H2O + CO2
26) CH3COOH + NaOH → CH3COONa + H2O
27) Ca(OH)2 + 2HBr → CaBr2 + 2H2O
28) Ca(OH)2 + 2HCl → CaCl2 + 2H2O
29) Ca(OH)2 + H2SO4 → CaSO4 + 2 H2O
30) Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
31) Na2S + H2SO4 → Na2SO4 + H2S
32) Na2S + 2HCl → 2NaCl + H2S
33) 2K3PO4 + 3Mg(OH)2 → 6KOH + Mg3 (PO4)2
34) Mg + 2HCl → MgCl2 + H2
35) Fe + H2SO4 → FeSO4 + H2
36) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
37) 2Al(OH)3 + 6HCl → 2AlCl3 + 6H2O
38) 2KMnO4 → K2MnO4 + MnO2 + O2
39) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
40) 2KNO3 → 2KNO2 + O2
41) Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
42) Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3
43) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
44) 2Al(OH)3 + 2NaOH → 2NaAlO2 + 4H2O
45) 2KClO3 → 2KCl + 3O2
45) Fe(NO3)3 + 3KOH → Fe(OH)3 + 3KNO3
46) H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2
47) 2HCl + CaCO3 → CaCl2 + H2O + CO2
48) Ba(OH)2 + HCl → BaCl2 + 2H2O
49) BaO + 2HBr → BaBr2 + H2O
50) 3Fe + 2O2 → Fe3O4
Bài 2:
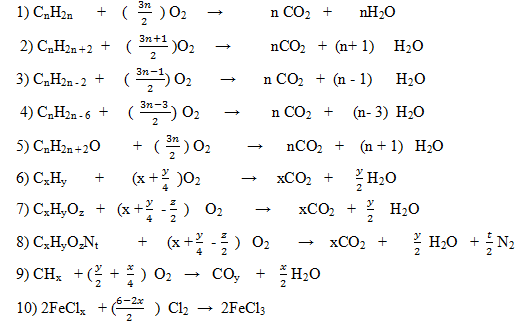
Bài 3:
a) 4Na + O2 → 2Na2O
Tỉ lệ: số nguyên tử Na: số phân tử O2: số phân tử Na2O = 4 : 1 : 2.
b) P2O5 + 3H2O → 2H3PO4
Tỉ lệ: Số phân tử P2O5 : số phân tử H2O: số phân tử H3PO4 = 1 : 3 : 2.
c) 2HgO → 2Hg + O2
Tỉ lệ: số phân tử HgO: số nguyên tử Hg: số phân tử O2 = 2 : 2 : 1.
d) 2Fe(OH)3 → Fe2O3 + 3H2O
Tỉ lệ: số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3.
Nguồn:Tổng hợp Internet
Học tốt!






Đây là một phương pháp khá đơn giản. Khi cân bằng ta cố ý viết các đơn chất khí (H2, O2, C12, N2…) dưới dạng nguyên tử riêng biệt rồi lập luận qua một số bước.
Ví dụ: Cân bằng phản ứng P + O2 –> P2O5
Ta viết: P + O –> P2O5
Để tạo thành 1 phân tử P2O5 cần 2 nguyên tử P và 5 nguyên tử O:
2P + 5O –> P2O5
Nhưng phân tử oxi bao giờ cũng gồm hai nguyên tử, như vậy nếu lấy 5 phân tử oxi tức là số nguyên tử oxi tăng lên gấp 2 thì số nguyên tử P và số phân tử P2O5 cũng tăng lên gấp 2, tức 4 nguyên tử P và 2 phân tử P2O5.
Do đó: 4P + 5O2 –> 2P2O5
2. Phương pháp hóa trị tác dụng
Hóa trị tác dụng là hóa trị của nhóm nguyên tử hay nguyên tử của các nguyên tố trong chất tham gia và tạo thành trong PUHH.
Áp dụng phương pháp này cần tiến hành các bước sau:
+ Xác định hóa trị tác dụng:
II – I III – II II-II III – I
BaCl2 + Fe2(SO4)3 –> BaSO4 + FeCl3
Hóa trị tác dụng lần lượt từ trái qua phải là:
II – I – III – II – II – II – III – I
Tìm bội số chung nhỏ nhất của các hóa trị tác dụng:
BSCNN(1, 2, 3) = 6
+ Lấy BSCNN chia cho các hóa trị ta được các hệ số:
6/II = 3, 6/III = 2, 6/I = 6
Thay vào phản ứng:
3BaCl2 + Fe2(SO4)3 –> 3BaSO4 + 2FeCl3
3. Phương pháp “chẵn – lẻ”
Một phản ứng sau khi đã cân bằng thì số nguyên tử của một nguyên tố ở vế trái bằng số nguyên tử nguyên tố đó ở vế phải. Vì vậy nếu số nguyên tử của một nguyên tố ở một vế là số chẵn thì số nguyên tử nguyên tố đó ở vế kia phải chẵn. Nếu ở một công thức nào đó số nguyên tử nguyên tố đó còn lẻ thì phải nhân đôi.
Ví dụ: FeS2 + O2 –> Fe2O3 + SO2
Ở vế trái số nguyên tử O2 là chẵn với bất kỳ hệ số nào. Ở vế phải, trong SO2 oxi là chẵn nhưng trong Fe2O3 oxi là lẻ nên phải nhân đôi. Từ đó cân bằng tiếp các hệ số còn lại.
2Fe2O3 –> 4FeS2 –> 8SO2 + 11O2
Đó là thứ tự suy ra các hệ số của các chất. Thay vào PTPU ta được:
4FeS2 + 11O2 –> 2Fe2O3 + 8SO2
4: phương pháp cân bằng electron
Nguyên tắc: dựa vào sự bảo toàn electron nghĩa là tổng số electron của chất khử cho phải bằng tổng số electron chất oxi hóa nhận.
Các bước cân bằng:
Bước 1: Viết sơ đồ phản ứng với các nguyên tố có sự thay đổi số oxi hóa.
Bước 2: Viết các quá trình: khử (cho electron), oxi hóa (nhận electron).
Bước 3:Cân bằng electron: nhân hệ số để:
Tổng số electron cho = tổng số electron nhận.
(tổng số oxi hóa giảm = tổng số oxi hóa tăng).
Bước 4: Cân bằng nguyên tố không thay đổi số oxi hoá (thường theo thứ tự:
kim loại (ion dương):
gốc axit (ion âm).
môi trường (axit, bazơ).
nước (cân bằng H2O để cân bằng hiđro).
Bước 5: Kiểm soát số nguyên tử oxi ở 2 vế (phải bằng nhau).
Lưu ý:
Khi viết các quá trình oxi hoá và quá trình khử của từng nguyên tố, cần theo đúng chỉ số qui định của nguyên tố đó.
Ví dụ:
Fe + H2SO4đặc nóng → Fe2(SO4)3 + SO2 + H2O
Fe0 → Fe+3 + 3e
1 x 2Fe0 → 2Fe+3 + 6e
3 x S+6 + 2e → S+4
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H20
5,: phương pháp cân bằng ion – electron:
Phạm vi áp dụng: đối với các quá trình xảy ra trong dung dịch, có sự tham gia của môi trường (H2O, dung dịch axit hoặc bazơ tham gia).
Các nguyên tắc:
•Nếu phản ứng có axit tham gia: vế nào thừa O phải thêm H+ để tạo H2O và ngược lại.
•Nếu phản ứng có bazơ tham gia: vế nào thừa O phải thêm H2O để tạo ra OH-
Các bước tiến hành:
Bước 1: Tách ion, xác định các nguyên tố có số oxi hóa thay đổi và viết các nửa phản ứng oxi hóa – khử.
Bước 2: Cân bằng các bán phản ứng:
Cân bằng số nguyên tử mỗi nguyên tố ở hai vế:
Thêm H+ hay OH-
Thêm H2O để cân bằng số nguyên tử hiđro
Kiểm soát số nguyên tử oxi ở 2 vế (phải bằng nhau).
Cân bằng điện tích: thêm electron vào mỗi nửa phản ứng để cân bằng điện tích
Bước 3: Cân bằng electron: nhân hệ số để:
Tổng số electron cho = tổng số electron nhận.
(tổng số oxi hóa giảm = tổng số oxi hóa tăng).
Bước 4: Cộng các nửa phản ứng ta có phương trình ion thu gọn.
Bước 5: Để chuyển phương trình dạng ion thu gọn thành phương trình ion đầy đủ và phương trình phân tử cần cộng vào 2 vế những lượng bằng nhau các cation hoặc anion để bù trừ điện tích.
Ví dụ: Cân bằng phương trình phản ứng:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
Bước 1: Cu + H+ + NO3- → Cu2+ + 2NO3- + NO + H2O
Cu0 → Cu2+
NO3-→ NO
Bước 2: Cân bằng nguyên tố:
Cu → Cu2+
NO3- + 4H+ → NO + 2H2O
Cân bằng điện tích
Cu → Cu2+ + 2e
NO3- + 4H+ + 3e → NO + 2H2O
Bước 3: Cân bằng electron:
3 x Cu → Cu2+ + 2e
2 x NO3- + 4H+ + 3e → NO + 2H2O
Bước 4: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2O
Bước 5: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
Nội dung 3: Các dạng phản ứng oxi hóa khử phức tạp
1. Phản ứng oxi hoá khử có hệ số bằng chữ
Nguyên tắc:
Cần xác định đúng sự tăng giảm số oxi hoá của các nguyên tố
Ví dụ:
Fe3O4 + HNO3→ Fe(NO3)3 + NxOy + H20
(5x – 2y) x 3Fe+8/3 → 3Fe+9/3 + e
1 x xN+5 + (5x – 2y)e → xN+2y/x
(5x-2y)Fe3O4+ (46x-18y)HNO3 → (15x-6y)Fe(NO3)3+NxOy+(23x-9y)H2O
2. Phản ứng có chất hh là tổ hợp của 2 chất khử
Nguyên tắc :
Cách 1 : Viết mọi phương trình biểu diễn sự thay đổi số oxi hoá, chú ý sự ràng buộc hệ số ở hai vế của phản ứng và ràng buộc hệ số trong cùng phân tử.
Cách 2 : Nếu một phân tử có nhiều nguyên tố thay đổi số oxi hoá có thể xét chuyển nhóm hoặc toàn bộ phân tử, đồng thời chú ý sự ràng buộc ở vế sau.
Luyện tập: Cân bằng phản ứng sau :
FeS2 + O2 → Fe2O3 + SO2
Fe+2 → Fe+3 + 1e
2S-1 → 2S+4 + 2.5e
4 x FeS2 → Fe+3 +2S+4 + 11e
11 x 2O0 + 4e → 2O
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3. Phản ứng có nguyên tố tăng hay giảm số oxi hoá ở nhiều nấc
oNguyên tắc :
• Cách 1 : Viết mọi phương trình thay đổi số oxi hoá, đặt ẩn số cho từng nấc tăng, giảm số oxi hoá.
•Cách 2 : Tách ra thành hai hay nhiều phương trình ứng với từng nấc số oxi hóa tăng hay giảm.
Ví dụ: Cân bằng phản ứng sau:
Al + HNO3→ Al(NO3)3 + NO + N2O + H2O
Cách 1: (3x + 8y) x Al0→ Al+3 + 3e
3 x xN+5 + 3xe → xN+5
3 x 2yN+5 + 8ye → 2yN+1
(3x+8y)Al +(12x+30y)HNO3→(3x+8y)Al(NO3)3+3xNO+3yNO2+(6x+15 y)H2O
Cách 2: Tách thành 2 phương trình :
a x Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
b x 8Al + 30 HNO3 → 8Al(NO3)3 +3N2O + 15H2O
(a+8b)Al + (4a+30b)HNO3 → (a+8b)Al(NO3)3 + a NO + 3b N2O+(2a+15b)H2O
4. Phản ứng không xác định rõ môi trường
oNguyên tắc:
•Có thể cân bằng nguyên tố bằng phương pháp đại số hoặc qua trung gian phương trình ion thu gọn.
•Nếu do gom nhiều phản ứng vào, cần phân tích để xác định giai đoạn nào là oxi hóa khử.
Ví dụ: Al + H2O + NaOH → NaAlO2 + H2
Al + H20 → Al(OH)3 + H2
2 x Al0 → Al+3 + 3e
3 x 2H+ + 2e → H2
2Al + 6H20 → 2Al(OH)3 + H2 (1)
2Al(OH)3 + 2NaOH → 2NaAlO2 + 4H20 (2)
Tổng hợp 2 phương trình trên:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Một số bài tập :
Bài 1
Cân bằng các PTHH sau :
1) MgCl2 + KOH → Mg(OH)2 + KCl
2) Cu(OH)2 + HCl → CuCl2 + H2O
3) Cu(OH)2 + H2SO4 → CuSO4 + H2O
4) FeO + HCl → FeCl2 + H2O
5) Fe2O3 + H2SO4 → Fe2 (SO4)3 + H2O
6) Cu(NO3)2 + NaOH → Cu(OH)2 + NaNO3
7) P + O2 → P2O5
8) N2 + O2 → NO
9) NO + O2 → NO2
10) NO2 + O2 + H2O → HNO3
11) SO2 + O2 → SO3
12) N2O5 + H2O → HNO3
13) Al2(SO4)3 + AgNO3 → Al(NO3)3 + Ag2SO4
14) Al2 (SO4)3 + NaOH → Al(OH)3 + Na2SO4
15) CaO + CO2 → CaCO3
16) CaO + H2O → Ca(OH)2
17) CaCO3 + H2O + CO2 → Ca(HCO3)2
18) Na + H3PO4 → Na2HPO4 + H2
19) Na + H3PO4 → Na3PO4 + H2
20) Na + H3PO4 → NaH2PO4 + H2
21) C2H2 + O2 → CO2 + H2O
22) C4H10 + O2 → CO2 + H2O
23) C2H2 + Br2 → C2H2Br4
24) C6H5OH + Na → C6H5ONa + H2
25) CH3COOH+ Na2CO3 → CH3COONa + H2O + CO2
26) CH3COOH + NaOH → CH3COONa + H2O
27) Ca(OH)2 + HBr → CaBr2 + H2O
28) Ca(OH)2 + HCl → CaCl2 + H2O
29) Ca(OH)2 + H2SO4 → CaSO4 + H2O
30) Ca(OH)2 + Na2CO3 → CaCO3 + NaOH
31) Na2S + H2SO4 → Na2SO4 + H2S
32) Na2S + HCl → NaCl + H2S
33) K3PO4 + Mg(OH)2 → KOH + Mg3 (PO4)2
34) Mg + HCl → MgCl2 + H2
35) Fe + H2SO4 → FeSO4 + H2
36) Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
37) Al(OH)3 + HCl → AlCl3 + H2O
38) KMnO4 → K2MnO4 + MnO2 + O2
39) MnO2 + HCl → MnCl2 + Cl2 + H2O
40) KNO3 → KNO2 + O2
41) Ba(NO3)2 + H2SO4 → BaSO4 + HNO3
42) Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
43) AlCl3 + NaOH → Al(OH)3 + NaCl
44) Al(OH)3 + NaOH → NaAlO2 + H2O
45) KClO3 → KCl + O2
45) Fe(NO3)3 + KOH → Fe(OH)3 + KNO3
46) H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2
47) HCl + CaCO3 → CaCl2 + H2O + CO2
48) Ba(OH)2 + HCl → BaCl2 + H2O
49) BaO + HBr → BaBr2 + H2O
50) Fe + O2 → Fe3O4
Bài 2 (*)
Lập phương trình hóa học của các phản ứng sau:
1) CnH2n + O2 → CO2 + H2O
2) CnH2n + 2 + O2 → CO2 + H2O
3) CnH2n - 2 + O2 → CO2 + H2O
4) CnH2n - 6 + O2 → CO2 + H2O
5) CnH2n + 2O + O2 → CO2 + H2O
6) CxHy + O2 → CO2 + H2O
7) CxHyOz + O2 → CO2 + H2O
8) CxHyOzNt + O2 → CO2 + H2O + N2
9) CHx + O2 → COy + H2O
10) FeClx + Cl2 → FeCl3
Bài 3
Cho sơ đồ của các phản ứng sau:
a) Na + O2 → Na2O b) P2O5 + H2O → H3PO4
c) HgO → Hg + O2 d) Fe(OH)3 → Fe2O3 + H2O
Lập PTHH và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
Lời giải tham khảo:
Bài 1.
1) MgCl2 + 2KOH → Mg(OH)2 + 2KCl
2) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
3) Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
4) FeO + 2HCl → FeCl2 + H2O
5) Fe2O3 + 3H2SO4 → Fe2 (SO4)3 + 3H2O
6) Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
7) 4P + 5O2 → 2P2O5
8) N2 + O2 → 2NO
9) 2NO + O2 → 2NO2
10) 4NO2 + O2 + 2H2O → 4HNO3
11) 2SO2 + O2 → 2SO3
12) N2O5 + H2O → 2HNO3
13) Al2(SO4)3 + 6AgNO3 → 2Al(NO3)3 + 3Ag2SO4
14) Al2 (SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
15) CaO + CO2 → CaCO3
16) CaO + H2O → Ca(OH)2
17) CaCO3 + H2O + CO2 → Ca(HCO3)2
18) 2Na + H3PO4 → Na2HPO4 + H2
19) 6Na + 2H3PO4 → 2Na3PO4 + 3H2
20) 2Na + 2H3PO4 → 2NaH2PO4 + H2
21) 2C2H2 + 5O2 → 4CO2 + 2H2O
22) 2C4H10 + 13O2 → 8CO2 + 10H2O
23) C2H2 + 2Br2 → C2H2Br4
24) 2 C6H5OH + 2Na → 2C6H5ONa + H2
25) CH3COOH+ Na2CO3 → CH3COONa + H2O + CO2
26) CH3COOH + NaOH → CH3COONa + H2O
27) Ca(OH)2 + 2HBr → CaBr2 + 2H2O
28) Ca(OH)2 + 2HCl → CaCl2 + 2H2O
29) Ca(OH)2 + H2SO4 → CaSO4 + 2 H2O
30) Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
31) Na2S + H2SO4 → Na2SO4 + H2S
32) Na2S + 2HCl → 2NaCl + H2S
33) 2K3PO4 + 3Mg(OH)2 → 6KOH + Mg3 (PO4)2
34) Mg + 2HCl → MgCl2 + H2
35) Fe + H2SO4 → FeSO4 + H2
36) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
37) 2Al(OH)3 + 6HCl → 2AlCl3 + 6H2O
38) 2KMnO4 → K2MnO4 + MnO2 + O2
39) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
40) 2KNO3 → 2KNO2 + O2
41) Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
42) Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3
43) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
44) 2Al(OH)3 + 2NaOH → 2NaAlO2 + 4H2O
45) 2KClO3 → 2KCl + 3O2
45) Fe(NO3)3 + 3KOH → Fe(OH)3 + 3KNO3
46) H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2
47) 2HCl + CaCO3 → CaCl2 + H2O + CO2
48) Ba(OH)2 + HCl → BaCl2 + 2H2O
49) BaO + 2HBr → BaBr2 + H2O
50) 3Fe + 2O2 → Fe3O4
Bài 2:
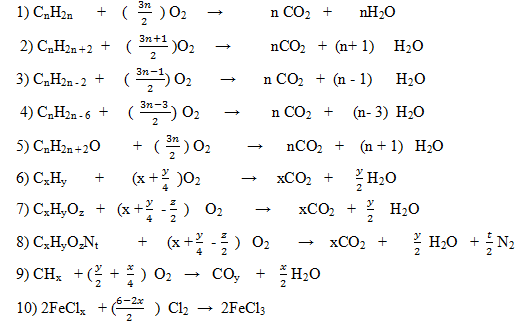
Bài 3:
a) 4Na + O2 → 2Na2O
Tỉ lệ: số nguyên tử Na: số phân tử O2: số phân tử Na2O = 4 : 1 : 2.
b) P2O5 + 3H2O → 2H3PO4
Tỉ lệ: Số phân tử P2O5 : số phân tử H2O: số phân tử H3PO4 = 1 : 3 : 2.
c) 2HgO → 2Hg + O2
Tỉ lệ: số phân tử HgO: số nguyên tử Hg: số phân tử O2 = 2 : 2 : 1.
d) 2Fe(OH)3 → Fe2O3 + 3H2O
Tỉ lệ: số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3.
Nguồn:Tổng hợp Internet
Học tốt!
Last edited:

