- 25 Tháng mười 2018
- 1,560
- 1,684
- 251
- 29
- Quảng Bình
- Đại học Sư phạm Huế
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
CROM VÀ HỢP CHẤT CỦA CROM
Trong đề thi THPT quốc gia thường có từ 1 - 2 câu hỏi về crom, có thể là dưới dạng câu hỏi lý thuyết hoặc là bài tập tính toán. Bài viết này là một bài tổng hợp ngắn về tính chất vật lý và tính chất hóa học của crom và hợp chất của crom.
Hy vọng bài viết này của mình sẽ có ích cho việc ôn tập của các bạn
I. VỊ TRÍ VÀ CẤU TẠO
- 24Cr: 1s22s22p63s23p63d54s1 hay [Ar] 3d54s1
Crom là kim loại chuyển tiếp, thuộc nhóm VIB, chu kì 4, số hiệu nguyên tử là 24.
Biểu diễn cấu hình electron qua ô lượng tử:
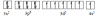
=> Trong hợp chất Cr có thể có số oxi hóa từ + 1 đến +6 nhưng phổ biến nhất là +2, +3, +6.
II. TÍNH CHẤT VẬT LÍ
- Crom có màu trắng ánh bạc, rất cứng (cứng nhất trong số các kim loại), khó nóng chảy (18900C).
- Mạng lập phương tâm khối.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
Ở nhiệt độ cao, crom tác dụng được với nhiều phi kim
4Cr + 3O2 → 2Cr2O3
2Cr + 3Cl2 → 2CrCl3
Cr + S → CrS
2. Tác dụng với axit
- Khi tác dụng với dung dịch HCl, H2SO4 loãng tạo ra muối Cr(II).
Cr + 2H+ → Cr2+ + H2
- Khi tác dụng với HNO3 (H2SO4 đặc) nóng thì tạo Cr3+ và sản phẩm khử của N+5 (hoặc của S+6).
- Cr không phản ứng với HNO3 và H2SO4 đặc nguội.
3. Tác dụng với dung dịch muối
- Thường tạo muối Cr3+
IV. ỨNG DỤNG
Thép chứa 2,8-3,8% crom có độ cứng cao, bền, có khả năng chống gỉ.
Thép chứa 18% crom là thép không gỉ (thép inox).
Thép chứa 25-30% crom siêu cứng dù ở nhiệt độ cao.
Crom dùng để mạ thép. Thép mạ crom bảo vệ kim loại khỏi bị ăn mòn và tạo vẻ đẹp cho đồ vật.
MỘT SỐ HỢP CHẤT CỦA CROM
I. HỢP CHẤT CROM (II)
- Một số hợp chất Cr(II)
a. CrO: Oxi bazơ, không tan, màu đen
b. Cr(OH)2: bazơ, không tan, màu vàng
c. Muối Cr2+ : màu
1. Tính khử
- Là tính chất hóa học đặc trưng của hợp chất Cr(II)
- CrO + O2 → Cr2O3
- Cr(OH)2 + O2 + H2O → Cr(OH)3
- CrCl2 + Cl2 → CrCl3
2. Tính oxi hóa
- CrO + Al → Al2O3 + Cr
III. HỢP CHẤT CROM (III)
1. Cr2O3 (Màu xanh lục)
Cr2O3 là oxit lưỡng tính, tan trong axit và kiềm đặc (không tan trong dung dịch kiềm).
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr2O3 được dùng tạo màu lục cho đồ sứ, đồ thủy tinh.
2. Cr(OH)3 (Kết tủa màu xanh lục)
Cr(OH)3 là hiroxit lưỡng tính, tan được trong dung dịch axit và dung dịch kiềm.
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
3. Muối crom (III)
Muối crom (III) có tính khử và tính oxi hóa.
a. Tính oxi hóa:
2CrCl3 + Zn → ZnCl2 + 2CrCl2
b. Tính khử: Cr(III) bị các chất oxi hóa mạnh oxi hóa thành Cr(VI).
2Cr3+ + 3Cl2 + 6OH- → 2CrO4- + 6Cl- + 8H2O
VD: 2CrBr3 + 3Br2 + 16KOH → 2K2CrO4 + 12KBr + 8H2O
III. HỢP CHẤT CROM (VI)
1. CrO3
- CrO3 là chất oxi hóa rất mạnh
+ Một số chất vô cơ và hữu cơ như S, P, C, NH3, C2H5OH … bốc cháy khi tiếp xúc với CrO3, CrO3 bị khử thành Cr2O3.
- CrO3 là oxit axit, khi tác dụng với nước tạo thành hỗn hợp axit cromic H2CrO4 và axit đicromic H2Cr2O7. Hai axit này không thể tách ra ở dạng tự do, chỉ tồn tại trong dung dịch. Nếu tách ra khỏi dung dịch, chúng bị phân hủy thành CrO3.
3CrO3 + 2H2O → H2CrO4 + H2Cr2O7
2. Muối cromat (CrO4-) và đicromat (Cr2O72-)
2CrO4- + 2H+ ↔ Cr2O72- + H2O
(màu vàng) (màu da cam)
Trong đề thi THPT quốc gia thường có từ 1 - 2 câu hỏi về crom, có thể là dưới dạng câu hỏi lý thuyết hoặc là bài tập tính toán. Bài viết này là một bài tổng hợp ngắn về tính chất vật lý và tính chất hóa học của crom và hợp chất của crom.
Hy vọng bài viết này của mình sẽ có ích cho việc ôn tập của các bạn
I. VỊ TRÍ VÀ CẤU TẠO
- 24Cr: 1s22s22p63s23p63d54s1 hay [Ar] 3d54s1
Crom là kim loại chuyển tiếp, thuộc nhóm VIB, chu kì 4, số hiệu nguyên tử là 24.
Biểu diễn cấu hình electron qua ô lượng tử:
=> Trong hợp chất Cr có thể có số oxi hóa từ + 1 đến +6 nhưng phổ biến nhất là +2, +3, +6.
II. TÍNH CHẤT VẬT LÍ
- Crom có màu trắng ánh bạc, rất cứng (cứng nhất trong số các kim loại), khó nóng chảy (18900C).
- Mạng lập phương tâm khối.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
Ở nhiệt độ cao, crom tác dụng được với nhiều phi kim
4Cr + 3O2 → 2Cr2O3
2Cr + 3Cl2 → 2CrCl3
Cr + S → CrS
2. Tác dụng với axit
- Khi tác dụng với dung dịch HCl, H2SO4 loãng tạo ra muối Cr(II).
Cr + 2H+ → Cr2+ + H2
- Khi tác dụng với HNO3 (H2SO4 đặc) nóng thì tạo Cr3+ và sản phẩm khử của N+5 (hoặc của S+6).
- Cr không phản ứng với HNO3 và H2SO4 đặc nguội.
3. Tác dụng với dung dịch muối
- Thường tạo muối Cr3+
IV. ỨNG DỤNG
Thép chứa 2,8-3,8% crom có độ cứng cao, bền, có khả năng chống gỉ.
Thép chứa 18% crom là thép không gỉ (thép inox).
Thép chứa 25-30% crom siêu cứng dù ở nhiệt độ cao.
Crom dùng để mạ thép. Thép mạ crom bảo vệ kim loại khỏi bị ăn mòn và tạo vẻ đẹp cho đồ vật.
MỘT SỐ HỢP CHẤT CỦA CROM
I. HỢP CHẤT CROM (II)
- Một số hợp chất Cr(II)
a. CrO: Oxi bazơ, không tan, màu đen
b. Cr(OH)2: bazơ, không tan, màu vàng
c. Muối Cr2+ : màu
1. Tính khử
- Là tính chất hóa học đặc trưng của hợp chất Cr(II)
- CrO + O2 → Cr2O3
- Cr(OH)2 + O2 + H2O → Cr(OH)3
- CrCl2 + Cl2 → CrCl3
2. Tính oxi hóa
- CrO + Al → Al2O3 + Cr
III. HỢP CHẤT CROM (III)
1. Cr2O3 (Màu xanh lục)
Cr2O3 là oxit lưỡng tính, tan trong axit và kiềm đặc (không tan trong dung dịch kiềm).
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr2O3 được dùng tạo màu lục cho đồ sứ, đồ thủy tinh.
2. Cr(OH)3 (Kết tủa màu xanh lục)
Cr(OH)3 là hiroxit lưỡng tính, tan được trong dung dịch axit và dung dịch kiềm.
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
3. Muối crom (III)
Muối crom (III) có tính khử và tính oxi hóa.
a. Tính oxi hóa:
2CrCl3 + Zn → ZnCl2 + 2CrCl2
b. Tính khử: Cr(III) bị các chất oxi hóa mạnh oxi hóa thành Cr(VI).
2Cr3+ + 3Cl2 + 6OH- → 2CrO4- + 6Cl- + 8H2O
VD: 2CrBr3 + 3Br2 + 16KOH → 2K2CrO4 + 12KBr + 8H2O
III. HỢP CHẤT CROM (VI)
1. CrO3
- CrO3 là chất oxi hóa rất mạnh
+ Một số chất vô cơ và hữu cơ như S, P, C, NH3, C2H5OH … bốc cháy khi tiếp xúc với CrO3, CrO3 bị khử thành Cr2O3.
- CrO3 là oxit axit, khi tác dụng với nước tạo thành hỗn hợp axit cromic H2CrO4 và axit đicromic H2Cr2O7. Hai axit này không thể tách ra ở dạng tự do, chỉ tồn tại trong dung dịch. Nếu tách ra khỏi dung dịch, chúng bị phân hủy thành CrO3.
3CrO3 + 2H2O → H2CrO4 + H2Cr2O7
2. Muối cromat (CrO4-) và đicromat (Cr2O72-)
2CrO4- + 2H+ ↔ Cr2O72- + H2O
(màu vàng) (màu da cam)

