 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Hôm nay chúng ta cùng tìm hiểu về Oxi - Ozon nhé 
1. Đặc điểm cấu tạo của nguyên tử oxi, thành phần đồng vị
- Oxi là nguyên tố thuộc chu kỳ 2, nhóm VIA, ô 8 trong bảng tuần hoàn và có cấu hình e là [tex]1s^{2}2s^{2}2p^{4}[/tex].
nên nguyên tử oxi có 2 cặp electron chưa ghép đôi gây ra trạng thái hóa trị 2 của oxi.
- Oxi có 6 đồng vị là :
[tex]_{8}^{14}\textrm{O}[/tex], [tex]_{8}^{15}\textrm{O}[/tex], [tex]_{8}^{16}\textrm{O}[/tex], [tex]_{8}^{17}\textrm{O}[/tex], [tex]_{8}^{18}\textrm{O}[/tex], [tex]_{8}^{19}\textrm{O}[/tex]
trong đó 3 đồng vị thiên nhiên là :
[tex]_{8}^{16}\textrm{O}[/tex] chiếm 99,759% tổng số nguyên tử
[tex]_{8}^{17}\textrm{O}[/tex] chiếm 0,037% tổng số nguyên tử
[tex]_{8}^{18}\textrm{O}[/tex] chiếm 0,204% tổng số nguyên tử
2. Đặc điểm cấu tạo phân tử O2
- Ở điều kiện thường, phân tử oxi gồm 2 nguyên tử, khoảng cách ngắn nhất giữa 2 nguyên tử trong phân tử là 1,21Å, ngắn hơn độ dài trong liên kết đơn O-O (1,48Å). Năng lượng liên kết là 494 kJ/mol, lớn hơn năng lượng liên kết đơn O-O (210kJ/mol).
-> Theo thuyết liên kết cộng hóa trị, trong phân tử oxi có một liên kết đôi, điều đó phù hợp với quy tắc bát tử, mỗi nguyên tử đã góp chung 2 electron để lớp vỏ ngoài cùng của mỗi nguyên tử đều có 8 electron nên có độ bền cao
- Tuy nhiên, oxi phân tử lại có tính thuận từ, chứng tỏ trong phân tử vẫn có 1 electron độc thân (điều này được giải thích dựa trên cơ sở thuyết orbital phân tử MO).
3. Trạng thái thiên nhiên và phương pháp điều chế
- Trạng thái tự nhiên :
Là nguyên tố phổ biến nhất trong thiên nhiên. Trong khí quyển Trái Đất, oxi có thành phần theo khối lượng là 23,15%, trong vỏ Trái Đất là 49,13%, trong chất sống là 70%.
- Phương pháp điều chế:
* Trong công nghiệp: Hóa lỏng không khí ở -196 độ C rồi cho bay hơi trở lại : Nitơ thoát ra trước, rồi đến oxi (-183 độ C). Phương pháp này gọi là chưng cất phân đoạn.
* Trong phòng thí nghiệm:
- Cho Na2O2 tác dụng với H2O:
2Na2O2 + 2H2O -> 4NaOH + O2
- Nung KMnO4:
2KMnO4 -> K2MnO4 + MnO2 + O2
- Nung KClO3 với xúc tác MnO2:
2KClO3 -> 2KCl + 3O2
- Nung muối nitrat:
2NaNO3 -> 2NaNO2 + O2
- Nung thủy ngân (II) oxit:
2HgO -> 2Hg + O2
- Điện phân nước với sự có mặt của NaOH hoặc Na2SO4:
2H2O -> 2H2 + O2
4. Tính chất hóa học
- Oxi là một phi kim hoạt động hóa học mạnh (độ âm điện chỉ kém flo), nên tác dụng trực tiếp với hầu hết các kim loại, trừ Au và Pt. Với Fe nung nóng, tạo oxi sắt từ :
3Fe + 2O2 -> Fe3O4
- Oxi tác dụng trực tiếp với các phi kim (trừ halogen) để tạo ra oxi axit hoặc oxit trung tính :
C + O2 -> CO2 hay N2 + O2 -> 2NO (> 2000 độ C)
Kết luận: Oxi là một đơn chất rất hoạt động, đặc biệt là ở nhiệt độ cao dễ tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất.
II. Ozon
1. Đặc điểm cấu tạo của nguyên tử ozon
- Ozon là 1 dạng thù hình của oxi, gồm 3 nguyên tử liên kết với nhau.
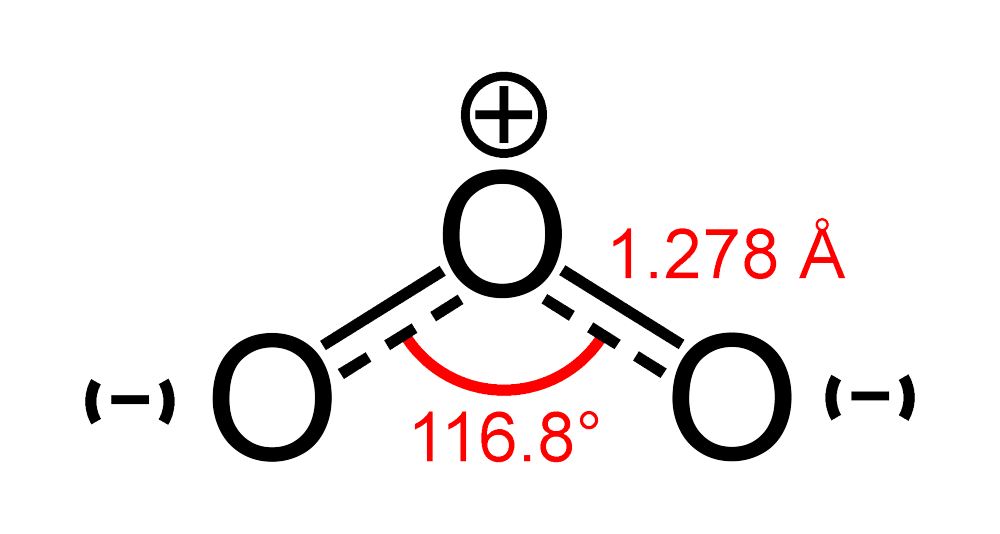 - Phân tử ozon có cấu trúc dạng góc, góc liên kết là 116,8 độ, độ dài liên kết giữa hai nguyên tử O là 1,278Å, momen lưỡng cực là μ = 0,52D.
- Phân tử ozon có cấu trúc dạng góc, góc liên kết là 116,8 độ, độ dài liên kết giữa hai nguyên tử O là 1,278Å, momen lưỡng cực là μ = 0,52D.
- Phân tử ozon có cực và góc hóa trị < 120 độ nên phân tử ozon không phải có cấu tạo dạng vòng
- Vì độ dài liên kết rong phân tử O3 là 1,278Å, trung gian giữa độ dài liên kết đơn O-O là 1,49Å (như trong phân tư H-OO-H) và độ dài liên kết đôi O=O là 1,21Å, do đó kết luận trong phân tử ozon có 1 phần liên kết kép giữa hai nguyên tử oxi.
2. Phương pháp điều chế
* Phương pháp điện phân:
- Phóng điện êm (phóng điện không phát ra tia lửa) trong khí O2 khô dựa vào quá trình
3O2 <-> 2O3
Quá trình này dựa vào máy điều chế ozon Siemen (hình dưới)
 - Để có hiệu suất cao hơn, người ta điện phân dung dịch H2SO4 loãng ở nhiệt độ thấp với điện cực platin, sản phẩm thu được là hỗn hợp O2-O3.
- Để có hiệu suất cao hơn, người ta điện phân dung dịch H2SO4 loãng ở nhiệt độ thấp với điện cực platin, sản phẩm thu được là hỗn hợp O2-O3.
* Phương pháp hóa học:
- Cho H2SO4 tác dụng với BaO2:
BaO2 + H2SO4 -> BaSO4 + H2O2
3H2O2 -> 3H2O + O3
- Đun nhẹ amonipesunfat với HNO3 đặc:
(NH4)2S2O8 + 2HNO3 -> H2S2O8 + 2NH4NO3
Axit H2S2O8 từ từ bị thủy phân hoàn toàn đến O3.
3. Tính chất hóa học
- Ozon kém bền và có tính oxi hóa mạnh, hơn oxi.
- Ozon bị phân hủy ngay ở điều kiện thường, tạo thành oxi nguyên tử và oxi phân tử: O3 -> O2 + O*
- Ozon oxi hóa hầu hết các kim loại (trừ Au và Pt). Ở điều kiện bình thường, O2 không oxi hóa được Ag, nhưng O3 oxi hóa Ag thành Ag2O:
2Ag + O3 -> Ag2O + O2
- Ozon đẩy được iot ra khỏi dung dịch KI (O2 không tác dụng với dung dịch KI)
2KI + O3 -> 2KOH + I2 + O2
PHẦN BÀI TẬP: https://hocmai.vn/kho-tai-lieu/read.php?id=5034

OXI - OZON
I. Oxi1. Đặc điểm cấu tạo của nguyên tử oxi, thành phần đồng vị
- Oxi là nguyên tố thuộc chu kỳ 2, nhóm VIA, ô 8 trong bảng tuần hoàn và có cấu hình e là [tex]1s^{2}2s^{2}2p^{4}[/tex].
nên nguyên tử oxi có 2 cặp electron chưa ghép đôi gây ra trạng thái hóa trị 2 của oxi.
- Oxi có 6 đồng vị là :
[tex]_{8}^{14}\textrm{O}[/tex], [tex]_{8}^{15}\textrm{O}[/tex], [tex]_{8}^{16}\textrm{O}[/tex], [tex]_{8}^{17}\textrm{O}[/tex], [tex]_{8}^{18}\textrm{O}[/tex], [tex]_{8}^{19}\textrm{O}[/tex]
trong đó 3 đồng vị thiên nhiên là :
[tex]_{8}^{16}\textrm{O}[/tex] chiếm 99,759% tổng số nguyên tử
[tex]_{8}^{17}\textrm{O}[/tex] chiếm 0,037% tổng số nguyên tử
[tex]_{8}^{18}\textrm{O}[/tex] chiếm 0,204% tổng số nguyên tử
2. Đặc điểm cấu tạo phân tử O2
- Ở điều kiện thường, phân tử oxi gồm 2 nguyên tử, khoảng cách ngắn nhất giữa 2 nguyên tử trong phân tử là 1,21Å, ngắn hơn độ dài trong liên kết đơn O-O (1,48Å). Năng lượng liên kết là 494 kJ/mol, lớn hơn năng lượng liên kết đơn O-O (210kJ/mol).
-> Theo thuyết liên kết cộng hóa trị, trong phân tử oxi có một liên kết đôi, điều đó phù hợp với quy tắc bát tử, mỗi nguyên tử đã góp chung 2 electron để lớp vỏ ngoài cùng của mỗi nguyên tử đều có 8 electron nên có độ bền cao
- Tuy nhiên, oxi phân tử lại có tính thuận từ, chứng tỏ trong phân tử vẫn có 1 electron độc thân (điều này được giải thích dựa trên cơ sở thuyết orbital phân tử MO).
3. Trạng thái thiên nhiên và phương pháp điều chế
- Trạng thái tự nhiên :
Là nguyên tố phổ biến nhất trong thiên nhiên. Trong khí quyển Trái Đất, oxi có thành phần theo khối lượng là 23,15%, trong vỏ Trái Đất là 49,13%, trong chất sống là 70%.
- Phương pháp điều chế:
* Trong công nghiệp: Hóa lỏng không khí ở -196 độ C rồi cho bay hơi trở lại : Nitơ thoát ra trước, rồi đến oxi (-183 độ C). Phương pháp này gọi là chưng cất phân đoạn.
* Trong phòng thí nghiệm:
- Cho Na2O2 tác dụng với H2O:
2Na2O2 + 2H2O -> 4NaOH + O2
- Nung KMnO4:
2KMnO4 -> K2MnO4 + MnO2 + O2
- Nung KClO3 với xúc tác MnO2:
2KClO3 -> 2KCl + 3O2
- Nung muối nitrat:
2NaNO3 -> 2NaNO2 + O2
- Nung thủy ngân (II) oxit:
2HgO -> 2Hg + O2
- Điện phân nước với sự có mặt của NaOH hoặc Na2SO4:
2H2O -> 2H2 + O2
4. Tính chất hóa học
- Oxi là một phi kim hoạt động hóa học mạnh (độ âm điện chỉ kém flo), nên tác dụng trực tiếp với hầu hết các kim loại, trừ Au và Pt. Với Fe nung nóng, tạo oxi sắt từ :
3Fe + 2O2 -> Fe3O4
- Oxi tác dụng trực tiếp với các phi kim (trừ halogen) để tạo ra oxi axit hoặc oxit trung tính :
C + O2 -> CO2 hay N2 + O2 -> 2NO (> 2000 độ C)
Kết luận: Oxi là một đơn chất rất hoạt động, đặc biệt là ở nhiệt độ cao dễ tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất.
II. Ozon
1. Đặc điểm cấu tạo của nguyên tử ozon
- Ozon là 1 dạng thù hình của oxi, gồm 3 nguyên tử liên kết với nhau.

- Phân tử ozon có cực và góc hóa trị < 120 độ nên phân tử ozon không phải có cấu tạo dạng vòng
- Vì độ dài liên kết rong phân tử O3 là 1,278Å, trung gian giữa độ dài liên kết đơn O-O là 1,49Å (như trong phân tư H-OO-H) và độ dài liên kết đôi O=O là 1,21Å, do đó kết luận trong phân tử ozon có 1 phần liên kết kép giữa hai nguyên tử oxi.
2. Phương pháp điều chế
* Phương pháp điện phân:
- Phóng điện êm (phóng điện không phát ra tia lửa) trong khí O2 khô dựa vào quá trình
3O2 <-> 2O3
Quá trình này dựa vào máy điều chế ozon Siemen (hình dưới)

* Phương pháp hóa học:
- Cho H2SO4 tác dụng với BaO2:
BaO2 + H2SO4 -> BaSO4 + H2O2
3H2O2 -> 3H2O + O3
- Đun nhẹ amonipesunfat với HNO3 đặc:
(NH4)2S2O8 + 2HNO3 -> H2S2O8 + 2NH4NO3
Axit H2S2O8 từ từ bị thủy phân hoàn toàn đến O3.
3. Tính chất hóa học
- Ozon kém bền và có tính oxi hóa mạnh, hơn oxi.
- Ozon bị phân hủy ngay ở điều kiện thường, tạo thành oxi nguyên tử và oxi phân tử: O3 -> O2 + O*
- Ozon oxi hóa hầu hết các kim loại (trừ Au và Pt). Ở điều kiện bình thường, O2 không oxi hóa được Ag, nhưng O3 oxi hóa Ag thành Ag2O:
2Ag + O3 -> Ag2O + O2
- Ozon đẩy được iot ra khỏi dung dịch KI (O2 không tác dụng với dung dịch KI)
2KI + O3 -> 2KOH + I2 + O2
PHẦN BÀI TẬP: https://hocmai.vn/kho-tai-lieu/read.php?id=5034
Last edited:

