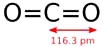Chương II. NITƠ & PHOTPHO
- Phân bón hóa học là những hóa chất có chứa các nguyên tố dinh dưỡng, được bón cho cây nhằm tăng năng suất cây trồng.
Vai trò của phân bón hóa học
- Phân bón hóa học gồm có 3 loại là: phân đạm, phân lân và phân kali.
I. PHÂN ĐẠM
- Phân đạm cung cấp nitơ hóa hợp cho cây dưới dạng ion nitrat NO3- và ion amoni NH4+.
- Độ dinh dưỡng của phân đạm bằng hàm lượng % N trong phân.
- Một số loại phân đạm thường dùng: NH4Cl, NH4NO3 (đạm 2 lá), (NH4)2SO4, NaNO3, (NH2)2CO (urê)...
Phân đạm
II. PHÂN LÂN
- Phân lân cung cấp cho cây trồng nguyên tố photpho ở dạng ion photphat.
Phân lân
- Độ dinh dưỡng của phân lân được tính bằng hàm lượng % của P2O5 tương ứng với lượng photpho có trong thành phần của phân đó.
- Nguyên liệu để sản xuất phân lân thường là quặng apatit, photphorit.
- Một số loại phân lân thường gặp:
1. Supephotphat
- Thành phần chính là Ca(H2PO4)2.
- Gồm 2 loại:
+ Supephotphat đơn:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
+ Supephotphat kép:
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
2. Phân lân nung chảy
III. PHÂN KALI
- Phân kali cung cấp cho cây trồng nguyên tố kali dưới dạng ion K+.
Phân kali
- Độ dinh dưỡng của phân kali được đánh giá bằng hàm lượng % K2O tương ứng với lượng kali có trong phân đó.
IV. MỘT SỐ LOẠI PHÂN BÓN HÓA HỌC KHÁC
1. Phân hỗn hợp và phân phức hợp
- Phân hỗn hợp cung cấp đồng thời 2 hoặc nhiều nguyên tố dinh dưỡng cơ bản được tạo thành khi trộn các loại phân đơn với nhau.
- Phân phức hợp là hỗn hợp các chất được tạo ra đồng thời bằng tương tác hóa học của các chất chứa đồng thời 2 hoặc 3 nguyên tố dinh dưỡng cơ bản. Ví dụ: amophot là hỗn hợp của (NH4)2HPO4 và NH4H2PO4.
AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT
I. ĐIPHOTPHO PENTAOXIT - P2O5
1. Tính chất vật lí
Là chất khói trắng, không mùi, háo nước và dễ chảy rữa thường dùng để làm khô các chất.
2. Tính chất hóa học
P2O5 có tính chất của một oxit axit.
- Tác dụng với nước:
P2O5 + H2O → 2HPO3 (axit metaphotphoric)
P2O5 + 3H2O → 2H3PO4 (axit photphoric)
- Tác dụng với dung dịch kiềm, tùy theo tỉ lệ có thể tạo thành các muối khác nhau:
H2O + P2O5 + 2NaOH → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
3. Điều chế
4P + 5O2 → 2P2O5
II. AXIT PHOTPHORIC HOẶC AXIT ORTHOPHOTPHORIC - H3PO4
1. Tính chất vật lí
Tồn tại ở dạng lỏng siro, không màu, không mùi, dễ tan trong nước và rượu, không độc.
2. Tính chất hóa học
a. Là axit trung bình
- Trong dung dịch H3PO4 phân li thuận nghịch theo 3 nấc:
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
HPO42- ↔ H+ + PO43-
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với oxit bazơ → muối + H2O
2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O
- Tác dụng với bazơ → muối + H2O (tùy theo tỉ lệ phản ứng có thể tạo thành các muối khác nhau).
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
- Tác dụng với kim loại đứng trước H2 → muối + H2
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
- Tác dụng với muối → muối mới + axit mới
H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4
b. Tính oxi hóa - khử
Trong H3PO4, P có mức oxi hóa +5 là mức oxi hóa cao nhất nhưng H3PO4 không có tính oxi hóa như HNO3 vì nguyên tử P có bán kính lớn hơn so với bán kính của N → mật độ điện dương trên P nhỏ → khả năng nhận e kém.
c. Các phản ứng do tác dụng của nhiệt
2H3PO4 → H4P2O7 + H2O (200 – 2500C)
Axit điphotphoric
H4P2O7 → 2HPO3 + H2O (400 – 5000C)
Axit metaphotphoric
Chú ý: Axit photphorơ H3PO3 là axit 2 lần axit.
3. Điều chế
- Trong phòng thí nghiệm:
P + 5HNO3 đặc → H3PO4 + 5NO2 + H2O (t0)
- Trong công nghiệp:
Ca3(PO4)2 + 3H2SO4 đặc → 3CaSO4 + 2H3PO4 (t0)
Để điều chế H3PO4 với độ tinh khiết cao ta dùng sơ đồ: P → P2O5 → H3PO4
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
4. Nhận biết
- Làm quỳ tím chuyển thành màu đỏ.
- Tạo kết tủa vàng với dung dịch AgNO3.
III. MUỐI PHOTPHAT
1. Khái niệm và tính chất vật lí
- Có 3 loại: PO43-, HPO42- và H2PO4-.
- Tất cả muối H2PO4- đều tan; muối PO43- và HPO42- chỉ có muối của kim loại kiềm và amoni tan được.
2. Tính chất hóa học
- Muối photphat có đầy đủ các tính chất hóa học của muối.
- Các muối photphat của kim loại kiềm dễ bị thủy phân trong dung dịch tạo môi trường bazơ:
Na3PO4 → 3Na+ + PO43-
PO43- + H2O → HPO42- + OH-
- Muối axit còn biểu hiện tính chất của axit.
NaH2PO4 + NaOH → Na2HPO4 + H2O
3. Điều chế
- Cho P2O5 hoặc H3PO4 tác dụng với dung dịch kiềm.
- Dùng phản ứng trao đổi ion.
4. Nhận biết
Nhận biết ion PO43- bằng dung dịch AgNO3:
3Ag+ + PO43- → Ag3PO4 (kết tủa vàng)
PHOTPHO
1. Tính chất vật lí
Thường gặp 2 dạng thù hình phổ biến là P đỏ và P trắng:
- P trắng là chất rắn trong suốt, màu trắng hoặc vàng nhạt, giống sáp, cấu trúc mạng tinh thể phân tử. P trắng mềm, dễ nóng chảy. P trắng không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ; rất độc, gây bỏng nặng khi rơi vào da; bốc cháy trong không khí ở nhiệt độ trên 400c, bảo quản bằng cách ngâm trong nước. Ở nhiệt độ thường, P trăng phát quang màu lục nhạt trong bóng tối.
- P đỏ là chất bột màu đỏ có cấu trúc polime, khó nóng chảy và khó bay hơi hơn P trắng; không tan trong các dung môi hữu cơ thông thường, dễ hút ẩm và chảy rữa, bền trong không khí ở nhiệt độ thường và không phát quang trong bóng tối. Chỉ bốc cháy ở nhiệt độ trên 2500c. Khi đun nóng không có không khí, P đỏ chuyển thành dạng hơi, khi làm lạnh thì hơi của nó ngưng tụ lại thành P trắng.
2. Tính chất hóa học
- Các mức oxi hóa có thể có của P: -3, 0, +3, +5.
- P hoạt động hóa học mạnh hơn N2 vì liên kết P - P kém bền hơn so với liên kết N ≡ N.
- P trắng hoạt động hơn P đỏ (vì P trắng có kiểu mạng phân tử còn P đỏ có cấu trúc kiểu polime).
a. Tính oxi hóa
P có phản ứng với nhiều kim loại → muối photphua:
2P + 3Mg → Mg3P2
Các muối photphua bị thủy phân mạnh giải phóng photphin (PH3).
Ca3P2 + 6H2O → 2PH3 + 3Ca(OH)2
Photphin là một khí không màu rất độc, có mùi tỏi, bốc cháy trong không khí ở nhiệt độ gần 1500C.
2PH3 + 4O2 → P2O5 + 3H2O
b. Tính khử
- Phản ứng với phi kim: O2, halogen...
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5 (nếu O2 dư)
(P trắng phản ứng được ở ngay nhiệt độ thường và có hiện tượng phát quang hóa học; P đỏ chỉ phản ứng khi nhiệt độ > 2500C).
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
- Phản ứng với các chất oxi hóa khác
6Pđ + 3KClO3 → 3P2O5 + 5KCl (t0) (phản ứng xảy ra khi quẹt diêm)
6Pt + 5K2Cr2O7 → 5K2O + 5Cr2O3 + 3P2O5
P + 5HNO3 → H3PO4 + 5NO2 + H2O
2P + 5H2SO4 đặc → 2H3PO4 + 3H2O + 5SO2
3. Trạng thái tự nhiên và điều chế
- Trong tự nhiên chỉ tồn tại ở dạng hợp chất. Hai khoáng vật chính là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2.
- Điều chế:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO (lò điện ở 15000C)
NITƠ
1. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo phân tử: N2 (N ≡ N).
- Chất khí, không màu, không mùi, không vị, không duy trì sự sống, sự cháy.
2. Tính chất hóa học
- Các mức oxi hóa có thể có của N: -3, 0, +1, +2, +3, +4, +5.
- Vì phân tử chứa liên kết ba rất bền vững nên ở điều kiện thường, nitơ là một chất ít hoạt động chỉ tham gia phản ứng ở nhiệt độ cao. Nitơ vừa là chất khử vừa là chất oxi hóa.
Cấu tạo phân tử N2
a. Nitơ là chất oxi hóa
- Tác dụng với kim loại → muối nitrua.
+ Nhiệt độ thường chỉ tác dụng với Li:
6Li + N2 → 2Li3N
+ Nhiệt độ cao phản ứng với một số kim loại như Mg, Ca và Al ...
2Al + N2 → 2AlN
3Ca + N2 → Ca3N2
- Tác dụng với H2 → Amoniac
N2 + 3H2 ↔ 2NH3 (> 4000C; Fe, p); ΔH = -92kJ
b. Nitơ là chất khử
N2 + O2 ↔ 2NO (Phản ứng xảy ra ở nhiệt độ 30000C hoặc có tia lửa điện)
2NO + O2 → 2NO2
(khí không màu) (khí màu nâu đỏ)
3. Điều chế
- Trong phòng thí nghiệm: nhiệt phân muối amoni nitrit
NH4NO2 → N2 + 2H2O (t0)
NH4Cl + NaNO2 → N2 + NaCl + 2H2O (t0)
- Trong công nghiệp: chưng cất phân đoạn không khí lỏng, dùng màng lọc rây phân tử.
4. Nhận biết
Trong các bài toán nhận biết, N2 thường được để lại để nhận biết sau cùng.
5. Trạng thái tự nhiên và ứng dụng
- Trong tự nhiên, nitơ tồn tại ở dạng tự do và trong hợp chất:
+ Dạng tự do: Nitơ chiếm 80% thể tích không khí.
+ Dạng hợp chất: có nhiều ở dạng NaNO3 (diêm tiêu natri), trong thành phần protein, axit nucleic...
- Ứng dụng: phần lớn được dùng để tổng hợp amoniac từ đó sản xuất ra các loại phân đạm, axit nitric... Dùng làm môi trường trơ cho các ngành công nghiệp luyện kim; nitơ lỏng được dùng để bảo quản máu và các các mẫu sinh học khác....
AXIT NITRIC VÀ MUỐI NITRAT
I. AXIT NITRIC
1. Tính chất vật lí
- Là chất lỏng, không màu, tan tốt trong nước (C < 65%).
- Trong điều kiện thường, dung dịch có màu hơi vàng do HNO3 bị phân hủy chậm:
4HNO3 → 4NO2 + 2H2O + O2
→ phải đựng dung dịch HNO3 trong bình tối màu.
2. Tính chất hóa học
a. HNO3 là một axit mạnh
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với oxit bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
2HNO3 + CuO → Cu(NO3)2 + H2O
- Tác dụng với bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
- Tác dụng với muối (trong muối kim loại đã đạt hóa trị cao nhất) → muối mới + axit mới:
2HNO3 + CaCO3 → Ca(NO3)2 + CO2 + H2O
b. HNO3 là chất oxi hóa mạnh
- Tác dụng với kim loại:
+ HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
M + HNO3 → M(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3)
+ Sản phẩm khử của N+5 là tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit. Thông thường thì dung dịch đặc → NO2, dung dịch loãng → NO; dung dịch axit càng loãng, kim loại càng mạnh thì N bị khử xuống mức càng sâu.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
8Na + 10HNO3 → 8NaNO3 + NH4NO3 + 3H2O
Chú ý: Nếu cho Fe hoặc hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 mà sau phản ứng còn dư kim loại → trong dung dịch Fe thu được chỉ ở dạng muối Fe2+. HNO3 đặc nguội thụ động với Al, Fe, Cr.
- Tác dụng với phi kim → NO2 + H2O + oxit của phi kim.
C + 4HNO3 → CO2 + 4NO2 + 2H2O
S + 4HNO3 → SO2 + 4NO2 + 2H2O
P + 5HNO3 → H3PO4 + 5NO2 + H2O
- Tác dụng với các chất khử khác (oxit bazơ, bazơ và muối trong đó kim loại chưa có hóa trị cao nhất...).
4HNO3 + FeO → Fe(NO3)3 + NO2 + 2H2O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
3. Điều chế
- Trong công nghiệp: NH3 → NO → NO2 → HNO3
4NH3 + 5O2 → 4NO + 6H2O (Pt, 8500C)
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
- Trong phòng thí nghiệm
H2SO4 đặc + NaNO3 tinh thể → HNO3 + NaHSO4
4. Nhận biết
- Làm đỏ quỳ tím.
- Tác dụng với kim loại đứng sau H tạo khí nâu đỏ.
5. Ứng dụng
Axit nitric là một trong những hóa chất cơ bản và quan trọng. Phần lớn axit này được dùng để sản xuất phân đạm. Ngoài ra nó còn được dùng để sản xuất thuốc nổ, thuốc nhuộm, dược phẩm...
II. MUỐI NITRAT
1. Khái niệm và công thức tổng quát
- Muối amoni là muối của axit nitric.
- Công thức tổng quát: M(NO3)n.
2. Tính chất vật lí
Tất cả các muối nitrat đều tan và là các chất điện li mạnh:
M(NO3)n → Mn+ + nNO3-
3. Tính chất hóa học
a. Muối nitrat có các tính chất hóa học chung của muối
- Tác dụng với axit → muối mới + axit mới
Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
- Tác dụng với ddịch bazơ → muối mới + bazơ mới
Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3
- Tác dụng với dung dịch muối → 2 muối mới
Mg(NO3)2 + Na2CO3 → MgCO3 + 2NaNO3
- Tác dụng với kim loại có tính khử mạnh hơn kim loại trong muối → muối mới + kim loại mới.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
b. Muối nitrat dễ bị nhiệt phân
- Nếu muối nitrat của kim loại đứng trước Mg → muối nitrit và O2
M(NO3)n → M(NO2)n + n/2O2
ví dụ:
NaNO3 → NaNO2 + 1/2O2
- Nếu muối của kim loại trung bình (từ Mg đến Cu) → oxit kim loại + NO2 + O2
2M(NO3)n → M2On + 2nNO2 + n/2O2
ví dụ:
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Nếu muối nitrat của kim loại sau Cu → kim loại + NO2 + O2
M(NO3)n → M + nNO2 + n/2O2
ví dụ:
AgNO3 → Ag + NO2 + 1/2O2
Chú ý: Một số muối nhiệt phân không theo quy luật trên như Fe(NO3)3, NH4NO3…
Nếu muối nitrat tồn tại trong môi trường axit thì cũng có tính oxi hóa mạnh như HNO3.
3Cu + 8HCl + 2KNO3 → 3CuCl2 + 2KCl + 2NO + 4H2O
4. Điều chế
Cho HNO3 phản ứng với kim loại, oxit kim loại, bazơ, muối bằng phản ứng trao đổi ion (muối trong đó kim loại giữ nguyên hóa trị) hoặc phản ứng oxi hóa khử (tạo muối kim loại có hóa trị cao).
5. Nhận biết
Dùng dung dịch HCl và mẩu Cu cho vào dung dịch cần nhận biết, nếu Cu tan tạo thành dung dịch màu xanh và có khí màu nâu đỏ bay ra thì đó là muối nitrat.
Cu + 4H+ + 2NO3- → Cu2+ + 2NO2 + 2H2O
AMONIAC VÀ MUỐI AMONI
I. AMONIAC
1. Cấu tạo và tính chất vật lí
- Công thức phân tử: NH3.
Mô hình phân tử amoniac
- Là chất khí không màu, mùi khai và xốc. Tan nhiều trong nước.
2. Tính chất hóa học
a. Tính bazơ yếu (do cặp e chưa tham gia liên kết ở nguyên tử N)
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
- Các phản ứng minh họa:
+ Phản ứng với nước:
NH3 + H2O ↔ NH4+ + OH-
→ Dung dịch NH3 làm cho quỳ tím chuyển màu xanh, phenolphtalein không màu chuyển màu hồng.
+ Phản ứng với axit → muối amoni:
NH3 (k) + HCl (k) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
+ Tác dụng với dung dịch muối của các kim loại mà hidroxit không tan → bazơ và muối:
2H2O + 2NH3 + MgCl2 → Mg(OH)2 + 2NH4Cl
Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)3](OH)2
xanh thẫm
Khi NH3 dư thì:
CuSO4 + 4NH3 → [Cu(NH3)3]SO4
b. Tính khử mạnh (do N trong NH3 có mức oxi hóa thấp nhất -3)
- Tác dụng với O2
4NH3 + 3O2 → 2N2 + 6H2O (t0 thường)
4NH3 + 5O2 → 4NO + 6H2O (8500C và có Pt làm xúc tác)
- Tác dụng với Cl2
2NH3 + 3Cl2 → N2 + 6HCl (t0)
8NH3 + 3Cl2 → N2 + 6NH4Cl
- Tác dụng với oxit của kim loại
3CuO + 2NH3 → N2 + 3H2O + N2 (t0)
3. Điều chế
- Trong công nghiệp: tổng hợp từ N2 và H2
N2 + 3H2 ↔ 2NH3 (4500C; Fe, p)
- Trong phòng thí nghiệm:
+ Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
+ Nhiệt phân muối amoni
NH4Cl → NH3 + HCl (t0)
NH4HCO3 → NH3 + H2O + CO2 (t0)
4. Nhận biết
- Khí không màu có mùi khai.
- Khí làm cho quỳ tím chuyển màu xanh hoặc làm cho phenolphtalein không màu chuyển màu hồng.
- Tạo khói trắng với HCl đặc.
5. Ứng dụng
- Sản xuất axit nitric, các loại phân đạm; điều chế hiđrazin làm nhiên liệu cho tên lửa.
- Amoniac lỏng được dùng làm chất gây lạnh trong máy lạnh.
II. MUỐI AMONI
1. Khái niệm và công thức tổng quát
- Muối amoni là muối của NH3 với axit.
- Công thức tổng quát: (NH4)xA.
2. Tính chất vật lí
- Tất cả các muối amoni đều tan và là những chất điện li mạnh.
(NH4)xA → xNH4+ + Ax-
- Nếu muối amoni của axit mạnh (A là gốc axit của một axit mạnh) thì thủy phân tạo môi trường axit.
NH4+ + H2O ↔ NH3 + H3O+
3. Tính chất hóa học
- Tác dụng với dung dịch axit → muối mới và bazơ mới
NH4HCO3 + HCl → NH4Cl + H2O + CO2
- Tác dụng với dung dịch bazơ → muối mới + NH3 + H2O
NH4Cl + NaOH → NH3 + H2O + NaCl
- Tác dụng với dung dịch muối → 2 muối mới
(NH4)2CO3 + CaCl2 → CaCO3 + 2NH4Cl
- Muối amoni còn dễ bị phân hủy bởi nhiệt → NH3 và axit tương ứng.
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + H2O + CO2
Nếu axit tạo ra có tính oxi hóa mạnh thì axit đó sẽ oxi hóa NH3 để tạo thành các sản phẩm khác:
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
4. Điều chế
- NH3 + axit.
- Dùng phản ứng trao đổi ion.
5. Nhận biết
Muối amoni tạo khí mùi khai với dung dịch kiềm
NH4+ + OH- → NH3 + H2O
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.