- 21 Tháng sáu 2017
- 476
- 888
- 184
- 23
- Hà Nội
- THPT Thanh Thủy
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
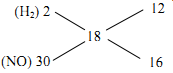
Cho $38,55$ gam hỗn hợp $Mg,Al,ZnO, Fe(NO_3)_2$ tan hoàn toàn trong dung dịch chứa $0,725$ mol $H_2SO_4$ loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu đc dung dịch Y chỉ chứ $96,55$ gam muối sunfat trung hòa và $3,92$ lít (đktc) khí Z gồm 2 khí trong đó có mốt khí hóa nâu ngoài không khí. Biết tỷ khối của Z so với $H_2$ là 9. Phần trăm mol của Mg trong hỗn hợp $X$ là bao nhiêu???