- 23 Tháng chín 2018
- 576
- 781
- 161
- TP Hồ Chí Minh
- Đại học sư phạm tphcm
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
I. Cấu tạo và tính chất vật lí
a. Cấu tạo
- Công thức phân tử: NH3.
- Cấu trúc phân tử:
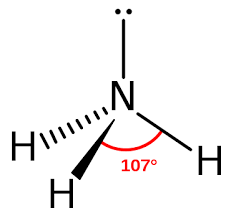
b. Tính chất vật lí
- Là chất khí không màu, mùi khai và xốc. Tan nhiều trong nước.
2. Tính chất hóa học
a. Tính bazơ yếu
Nhận xét: N trong NH3 còn 1 cặp electron chưa tham gia liên kết nên nhận proton → có tính bazơ yếu.
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
- Tác dụng với nước:
NH3 + H2O ↔ NH4+ + OH-
→ Dung dịch NH3 làm cho quỳ tím chuyển màu xanh, phenolphtalein không màu chuyển màu hồng.
- Tác dụng với axit → muối amoni
NH3 (k) + HCl (k) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
- Tác dụng với dung dịch muối của các kim loại mà hiđroxit không tan → bazơ và muối:
2H2O + 2NH3 + MgCl2 → Mg(OH)2 + 2NH4Cl
Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)3](OH)2
xanh thẫm
b. Tính khử mạnh
- Số oxi hóa của nitơ: -3 0 +1 +2 +3 +4 +5
- Nhận xét: N trong NH3 có mức oxi hóa thấp nhất nên NH3 có tính khử mạnh.
- Tác dụng với O2
4NH3 + 3O2 → 2N2 + 6H2O (t0 thường)
4NH3 + 5O2 → 4NO + 6H2O (8500C và có Pt làm xúc tác)
- Tác dụng với Cl2
2NH3 + 3Cl2 → N2 + 6HCl (t0)
8NH3 + 3Cl2 → N2 + 6NH4Cl
- Tác dụng với oxit của kim loại
3CuO + 2NH3 → N2 + 3H2O + N2 (t0)
* Kết luận
- NH3 có tính bazơ khi phản ứng H2O, axit và dung dịch muối của bazơ không tan.
- NH3 thể hiện tính khử mạnh khi tác dụng với các chất oxi hóa.
3. Điều chế
a. Trong phòng thí nghiệm
- Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
- Nhiệt phân muối amoni
NH4Cl → NH3 + HCl (t0)
NH4HCO3 → NH3 + H2O + CO2 (t0)
b. Trong công nghiệp: tổng hợp từ N2 và H2
N2 + 3H2 ↔ 2NH3 (4500C; Fe, p)
4. Nhận biết amoniac
- Khí không màu có mùi khai.
- Khí làm cho quỳ tím chuyển màu xanh hoặc làm cho phenolphtalein không màu chuyển màu hồng.
- Tạo khói trắng với HCl đặc.
a. Cấu tạo
- Công thức phân tử: NH3.
- Cấu trúc phân tử:

b. Tính chất vật lí
- Là chất khí không màu, mùi khai và xốc. Tan nhiều trong nước.
2. Tính chất hóa học
a. Tính bazơ yếu
Nhận xét: N trong NH3 còn 1 cặp electron chưa tham gia liên kết nên nhận proton → có tính bazơ yếu.
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
- Tác dụng với nước:
NH3 + H2O ↔ NH4+ + OH-
→ Dung dịch NH3 làm cho quỳ tím chuyển màu xanh, phenolphtalein không màu chuyển màu hồng.
- Tác dụng với axit → muối amoni
NH3 (k) + HCl (k) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
- Tác dụng với dung dịch muối của các kim loại mà hiđroxit không tan → bazơ và muối:
2H2O + 2NH3 + MgCl2 → Mg(OH)2 + 2NH4Cl
Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)3](OH)2
xanh thẫm
b. Tính khử mạnh
- Số oxi hóa của nitơ: -3 0 +1 +2 +3 +4 +5
- Nhận xét: N trong NH3 có mức oxi hóa thấp nhất nên NH3 có tính khử mạnh.
- Tác dụng với O2
4NH3 + 3O2 → 2N2 + 6H2O (t0 thường)
4NH3 + 5O2 → 4NO + 6H2O (8500C và có Pt làm xúc tác)
- Tác dụng với Cl2
2NH3 + 3Cl2 → N2 + 6HCl (t0)
8NH3 + 3Cl2 → N2 + 6NH4Cl
- Tác dụng với oxit của kim loại
3CuO + 2NH3 → N2 + 3H2O + N2 (t0)
* Kết luận
- NH3 có tính bazơ khi phản ứng H2O, axit và dung dịch muối của bazơ không tan.
- NH3 thể hiện tính khử mạnh khi tác dụng với các chất oxi hóa.
3. Điều chế
a. Trong phòng thí nghiệm
- Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
- Nhiệt phân muối amoni
NH4Cl → NH3 + HCl (t0)
NH4HCO3 → NH3 + H2O + CO2 (t0)
b. Trong công nghiệp: tổng hợp từ N2 và H2
N2 + 3H2 ↔ 2NH3 (4500C; Fe, p)
4. Nhận biết amoniac
- Khí không màu có mùi khai.
- Khí làm cho quỳ tím chuyển màu xanh hoặc làm cho phenolphtalein không màu chuyển màu hồng.
- Tạo khói trắng với HCl đặc.

