[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Khái quát về Halogen
I. Nhóm halogen trong bảng tuần hoàn các nguyên tố
- Gồm có các nguyên tố 9F, 17Cl, 35Br, 53I, 85At.
- Phân tử dạng X2, ở điều kiện thường : F2 khí màu lục nhạt, Cl2 khí màu vàng lục, Br2 lỏng màu nâu đỏ, I2 tinh thể tím.
II. Cấu hình electron nguyên tử và cấu tạo phân tử của các nguyên tố trong nhóm halogen
- Cấu hình electron lớp ngoài cùng của nguyên tử các halogen có dạng ns2-np5
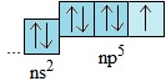
-> Dễ nhận thêm 1e để đạt tới cấu hình bền vững của khí hiếm : X + 1e -> X-
- Ở trạng thái cơ bản, nguyên tử các halogen đều có một electron độc thân.
- Lớp electron ngoài cùng của nguyên tử flo là lớp thứ hai nên không có phân lớp d. Nguyên tử clo, brom và iot có phân lớp d còn trống, khi được kích thích 1, 2 hoặc 3 electron có thể chuyển đến những obitan d còn trống :
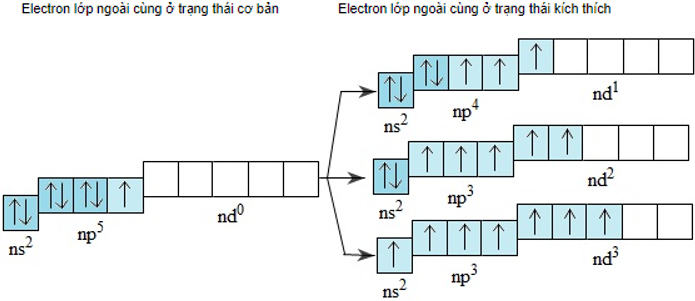
-> Ở các trạng thái kích thích, nguyên tử clo, brom hoặc iot có thể có 3, 5 hoặc 7 electron độc thân.
III. Hóa tính
- Cấu hình e lớp ngoài cùng tương tự nhau nên các halogen có nhiều điểm giống nhau về tính chất hóa học:
+ Có 7 e lớp ngoài cùng nên có xu hướng nhận thêm 1 e tạo thành ion âm X-.
+ Là phi kim điển hình, có tính oxi hóa mạnh.
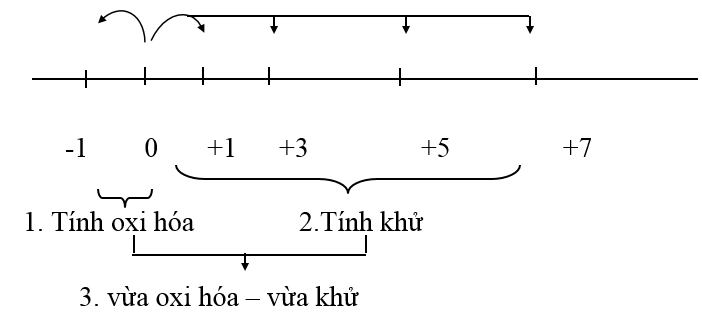
- Tính oxi hóa của halogen:
+ Nhóm halogen với 7 điên tử ở lớp ngoài cùng và độ âm điện lớn, nguyên tử halogen X dễ dàng lấy 1 điện tử tạo ra X- có cấu hình khí hiếm bền vững.
+ Do đó tính chất quan trọng nhất của nhóm halogen là tính oxi hóa, tính này giảm dần từ F2 (chất oxi hóa mạnh nhất) đến I2 (chất oxi hóa trung bình).
+ Các bậc oxi hóa đặc trưng của các halogen là: -1, 0, +1, +3, +5, +7 (trừ F luôn có số oxi hóa -1).