T
trangbien
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Số electron tối đa trong mỗi lớp nguyên tử
Trong 1 phân lớp: phân lớp s chứa tối đa 2 electron; phân lớp p chứa tối đa 6 electron; phân lớp d chứa tối đa 10 electron; phân lớp f chứa tối đa 14 electron. Từ đó tính ra số e tối đa trong 1 lớp là:
Ví dụ lớp 1: chỉ có phân lớp s, mà phân lớp s có tối đa 2 e. Vậy lớp 1 có tối đa 2 e.
Ví dụ lớp 3 có 3 phân lớp s, p, d, vậy số e tối đa: 2 + 6 + 10 =18 e.
lớp 4 có 4 phân lớp s, p, d, f: số e tối đa: 2 + 6 + 10 + 14 = 32 e.
Điền electron vào các lớp
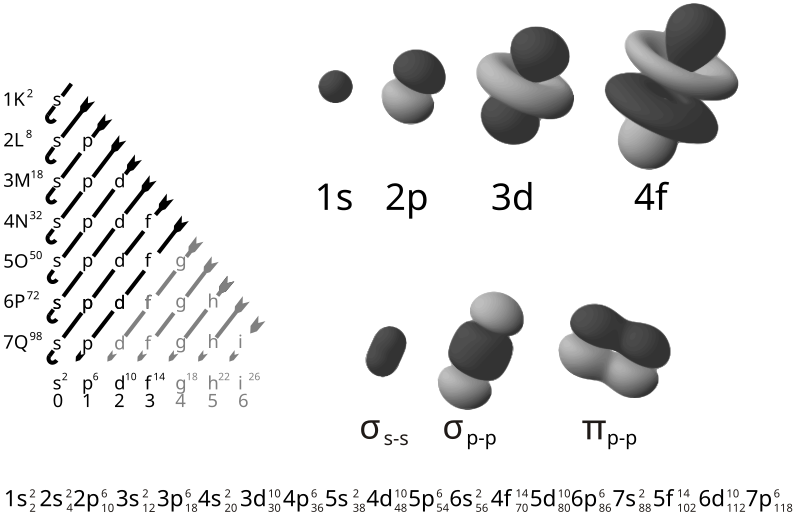
Các electron sẽ điền theo thứ tự vào các lớp có năng lượng từ thấp đến cao, bắt đầu là lớp 1s. Ngoài ra theo quy tắc Hund, các lớp electron có cùng mức năng lượng thì ban đầu được điền đơn, sao cho số electron độc thân là lớn nhất, sau đấy mới được điền đôi.
Sự điền electron vào các lớp không chỉ phụ thuộc vào vị trí hay khoảng cách của chúng đến hạt nhân mà còn phụ thuộc vào mức năng lượng của các lớp.
Ví dụ: titan có Z = 22, cấu hình theo thứ tự các lớp 1s2 2s2 2p6 3s2 3p6 3d4 4s0 nhưng do năng lượng của lớp 4s thấp hơn lớp 3d nên 4 electron còn lại sẽ điền đầy vào lớp 4s (2) trước, sau đấy mới đến lớp 3d (2), cấu hình đúng của titan là 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Trong 1 phân lớp: phân lớp s chứa tối đa 2 electron; phân lớp p chứa tối đa 6 electron; phân lớp d chứa tối đa 10 electron; phân lớp f chứa tối đa 14 electron. Từ đó tính ra số e tối đa trong 1 lớp là:
Ví dụ lớp 1: chỉ có phân lớp s, mà phân lớp s có tối đa 2 e. Vậy lớp 1 có tối đa 2 e.
Ví dụ lớp 3 có 3 phân lớp s, p, d, vậy số e tối đa: 2 + 6 + 10 =18 e.
lớp 4 có 4 phân lớp s, p, d, f: số e tối đa: 2 + 6 + 10 + 14 = 32 e.
Điền electron vào các lớp

Các electron sẽ điền theo thứ tự vào các lớp có năng lượng từ thấp đến cao, bắt đầu là lớp 1s. Ngoài ra theo quy tắc Hund, các lớp electron có cùng mức năng lượng thì ban đầu được điền đơn, sao cho số electron độc thân là lớn nhất, sau đấy mới được điền đôi.
Sự điền electron vào các lớp không chỉ phụ thuộc vào vị trí hay khoảng cách của chúng đến hạt nhân mà còn phụ thuộc vào mức năng lượng của các lớp.
Ví dụ: titan có Z = 22, cấu hình theo thứ tự các lớp 1s2 2s2 2p6 3s2 3p6 3d4 4s0 nhưng do năng lượng của lớp 4s thấp hơn lớp 3d nên 4 electron còn lại sẽ điền đầy vào lớp 4s (2) trước, sau đấy mới đến lớp 3d (2), cấu hình đúng của titan là 1s2 2s2 2p6 3s2 3p6 3d2 4s2

