H
huongkc
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Đề thi OLYMPIC môn hóa học lớp 10 không chuyên
thời gian 120 phút
thời gian 120 phút
Câu I (4 điểm)
Cho sơ đồ:
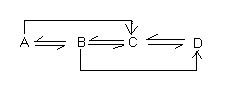
Biết A,B,C,D là các hợp chất của lưu huỳnh với các số OXH khác nhau hoặc lưu huỳnh đơn chất. Xác định các chất thích hợp bà viết các phương trình hóa học hoàn thành sơ đồ trên.
Câu II: ( 4 điểm)
Hoàn thành và cân bằng các phương trình phản ứng sau theo phương pháp thăng bằng electron
1,[TEX] K_2Cr_2O_7 + HCl => ...[/TEX]
2, [TEX]FeS + Cu_2S + HNO_3 => NO + ...[/TEX]
(biết tỉ lệ mol giữa [TEX]FeS[/TEX] và [TEX]CU_2S[/TEX] là 1:1)
3,[TEX] SO_2 + KMnO_4 + H_2O => ...[/TEX]
4, [TEX]NaIO_x +SO_2 +H_2O => I_2 + Na_2SO_4 + H_2SO_4[/TEX]
Câu III ( 3 điểm)
1, Để xác định hàm lượng sắt tinhkhiết có trong 1 mẫu sắt có lẫn tạp chất là [TEX]Fe_2O_3[/TEX], người ta hòa tan [TEX]7,2[/TEX] gam mẫu này vào 1 lượng vừa đủ dung dịch [TEX]H_2SO_4[/TEX] loãng rồi thêm nước cất vào để được [TEX]500 ml[/TEX] dung dịch [TEX]A [/TEX]chứa [TEX]1[/TEX] muối duy nhất. Lấy [TEX]1/10 [/TEX]dung dịch [TEX]A [/TEX]cho tác dụng với dung dịch [TEX]KMnO_4[/TEX] trong [TEX]H_2SO_4[/TEX] thì cần dùng hết [TEX]25ml[/TEX] dung dịch. Hỏi trong mẫu sắt trên chứa bao nhiều phần trăng tạp chất.
2, Hãy nêu 1 phương pháp để tinh chế [TEX]NaCl[/TEX] rắn có lẫn các muối khan [TEX]NaBr, NaI, Na_2CO_3[/TEX]
Câu IV ( 4,5 điểm)
1, Cho [TEX]2,79[/TEX] gam hỗn hợp [TEX]X[/TEX] (gồm bột [TEX]Zn[/TEX] và [TEX]Fe[/TEX]) vào [TEX]150 ml[/TEX] dung dịch [TEX]Y[/TEX]( chứa [TEX]2[/TEX] axit [TEX]HCl 0,5 M[/TEX] và [TEX]H_2SO_4 0,15 M[/TEX]).
a/Hãy chứng minh hỗn hợp X tan hết trong dung dịch [TEX]Y[/TEX].
b/ Khi [TEX]X[/TEX] tan hết thấy có [TEX]1,008 l[/TEX] khí [TEX]H_2[/TEX] ở đktc thoát ra. thu được dung dịch [TEX]Z[/TEX] sau phản ứng. Đem cô cạn cẩn thận dung dịch [TEX]Z[/TEX] thu được bao nhiêu gam muối khan?
c/ [TEX]T[/TEX] là dung dịch hỗn hợp [TEX]KOH 0,2 M[/TEX] và [TEX]Ba(OH)_2 0,1 M[/TEX]. Tính thể tích dung dịch [TEX]T[/TEX] tối thiểu cần thêm vào dung dịch [TEX]Z[/TEX] để thu được lượng kết tủa nhỏ nhất. Xác định khối lượng kết tủa này.
Cho biết [TEX]Zn(OH)_2[/TEX] tan được cả trong dung dịch axit và dung dịch kiềm.
2, Có các hợp chất [TEX]HClO_4, HBrO_4, HIO_4[/TEX]. Hãy cho biết tên của các hợp chất này và xắp xếp theo thứ tự tính axit tăng dần. Giải thích.
Câu V: (4,5 điểm)
1, Nguyên tử X có cấu hình electron lớp ngoài cùng là [TEX]4s1[/TEX]. Viết cấu hình electron đầy đủ của [TEX]X[/TEX]. Xác định số elctron độc thân ở trạng thái cơ bản của [TEX]X[/TEX].
2, Hợp chấy [TEX]M[/TEX] được tạo bởi ion[TEX] X+[/TEX] và [TEX]Y2-[/TEX], có tổng số proton là [TEX]70[/TEX]. Hai ion này đều được tạo bởi [TEX]5[/TEX] nguyên tử của [TEX]2[/TEX] nguyên tố. Tổng số proton trong [TEX]X+[/TEX] là [TEX]11[/TEX]. Hai nguyên tố trong [TEX]Y2-[/TEX] thuộc cùng [TEX]1[/TEX] nhóm và ở [TEX]2[/TEX] chu kì liên tiếp trong bảng tuần hoàn.
a/ xác định công thức hoá học của [TEX]M[/TEX]
b/ Hãy cho biết loại liên kết có trong [TEX]M[/TEX]
Last edited by a moderator:

