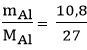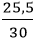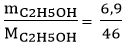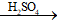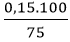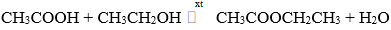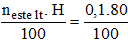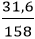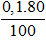- 26 Tháng tám 2021
- 1,369
- 1,660
- 216
- Bình Định
- Viện dầu và cây có dầu
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Một dạng toán cơ bản quen thuộc nhưng đôi lúc các bạn vẫn còn nhầm lẫn nên mình làm topic này hi vọng khi các bạn gặp dạng toán này thì sẽ không còn lăn tăn suy nghĩ nữa nhé 
 . Let's do it
. Let's do it
DẠNG TOÁN HIỆU SUẤT PHẢN ỨNG
A. Lý thuyết & Phương pháp giải
1. Các bước giải bài tập tình hiệu suấtBước 1: Viết phương trình phản ứng và cân bằng phản ứng
Bước 2: Tính theo phương trình khối lượng sản phẩm tạo thành (mlt)
Bước 3: Dựa vào giả thiết tính khối lượng thực tế thu được (mtt)
Bước 4: Tính hiệu suất
2. Công thức tính hiệu suất: H =
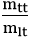
Trong đó:
+ mtt: khối lượng thực tế
+ mlt: khối lượng tính theo lý thuyết
+ H: hiệu suất
3. Công thức tính khối lượng chất tham gia khi có hiệu suất: mtt =
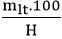
4. Công thức tính khối lượng sản phẩm khi có hiệu suất: mtt =
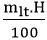
B. Ví dụ minh họa
Ví dụ 1: Người ta nung 4,9 gam [imath]KClO_3[/imath] có xúc tác thu được 2,5 gam KCl và một lượng khí oxi.a. Viết phương trình hóa học xảy ra.
b. Tính hiệu suất của phản ứng
Hướng dẫn giải:
a. Phương trình hóa học: 2[imath]KClO_3[/imath]

b. [imath]n_{KClO_3}[/imath] =
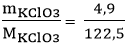
2[imath]KClO_3[/imath]

1............. → 1 mol
0,04......... → 0,04 (mol)
Khối lượng KCl thu được theo lý thuyết là:
mlt = [imath]m_{KCl}[/imath]= 2,98 gam
Hiệu suất của phản ứng là: H =
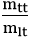
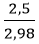
Ví dụ 2: Nung nóng kali nitrat KNO3, chất này bị phân hủy tạo thành kali nitrit [imath]KNO_2[/imath] và [imath]O_2[/imath]. Tính khối lượng [imath]KNO_3[/imath] cần dùng để điều chế được 2,4 gam [imath]O_2[/imath]. Biết hiệu suất phản ứng đạt 85%.
Hướng dẫn giải:
[imath]n_{O_2}[/imath]= 0,075 mol
2[imath]KNO_3[/imath]

2 ← ...........................1 mol
0,15 ← .....................0,075 mol
Khối lượng [imath]KNO_3[/imath] theo lý thuyết là: mlt = 0,15.101 = 15,15 gam.
Khối lượng [imath]KNO_3[/imath] thực tế cần dùng là: mtt =
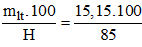
C. Bài tập vận dụng
Câu 1. Trộn 10,8 g bột nhôm với bột lưu huỳnh dư. Cho hỗn hợp vào ống nghiệm và đun nóng để phản ứng xảy ra thu được 25,5 g Al2S3. Tính hiệu suất phản ứng ?A. 85%
B. 80%
C. 90%
D. 92%
Câu 2. Tính thể tích C2H4 (đktc) cần để điều chế được 6,9 gam rượu etylic. Biết hiệu suất phản ứng là 75%. Phản ứng theo sơ đồ: C2H4 + H2O C2H5OH.
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Câu 3. Cho 13,6 gam hỗn hợp X gồm axit axetic (CH3COOH) và rượu etylic (C2H5OH) được trộn theo tỉ lệ mol tương ứng là 3 : 2. Đun nóng X với H2SO4 đặc một thời gian thu được m gam este CH3COOCH2CH3 với hiệu suất phản ứng là 80%. Giá trị của m là
A. 7,04g.
B. 8,80g.
C. 10,56g.
D. 11,00g.
Câu 4. Cho phương trình: 2[imath]KMnO_4[/imath]

Nhiệt phân 31,6 gam [imath]KMnO_4[/imath] thu được V lít [imath]O_2[/imath] (đktc), biết hiệu suất phản ứng 80% . Giá trị của V là
A. 2,24 lít
B. 1,792 lít
C. 10,08 lít
D. 8,96 lít
@nguyenhonggiasinh@gmail.com