- 29 Tháng sáu 2017
- 5,209
- 8,405
- 944
- 25
- Cần Thơ
- Đại học Cần Thơ
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chào mọi người!!!
Nếu đã là một người học hoá chắc hẳn bạn đã từng biết qua khái niệm "bảng tuần hoàn các nguyên tố hóa học". Chỉ một cái bảng nhỏ thôi cũng đã chứa đựng biết bao quyền năng của môn Hóa rồi!!! Hôm nay, cùng với Nhật tìm hiểu về bảng tuần hoàn thần thánh này nhé!!!

(Bảng tuần hoàn các nguyên tố hóa học)
1. Tác giả (người sáng lập)
Thật ra trong lịch sử, đã có rất nhiều nhà khoa học nghiên cứu và vẽ ra những hệ thống cơ bản của các nguyên tố hóa học như J.L.Meyer, W.Odling, J.Newlands,..... Tuy nhiên, nhắc đến bảng tuần hoàn thì người có công lớn nhất trong việc sáng lập là Dmitri Ivanovich Mendeleev (1834-1907, Nga). Ông là người đã mô tả gần như chính xác thứ tự cũng như tính chất của các nguyên tố.
2. Kích thước.
Bảng tuần hoàn ngày càng mở rộng với sự xuất hiện của rất nhiều các nguyên tố nhân tạo. Hiện nay, bảng tuần hoàn có 118 ô đại diện cho 118 nguyên tố hóa học, trong đó có 98 nguyên tố tự nhiên. Nguyên tố đầu tiên là hidro (Z=1) và nguyên tố cuối cùng được phát hiện là oganesson (Z=118).
3. Cách sắp xêp
a, Nhóm
Nhóm là khái niệm để chỉ tập hợp các nguyên tố có cấu trúc electron tương đồng với nhau (một số tài liệu định nghĩa nhóm là tập hợp các nguyên tố có cùng số electron hóa trị), do đó chúng có các đặc tính gần như giống nhau. Trong bảng tuần hoàn, các nguyên tố trong nhóm được bố trí trong cùng một cột (ngoại trừ nhóm VIIB bao gồm đến 3 cột).
Bảng tuần hoàn bao gồm 16 nhóm trong đó có 8 phân nhóm chính nhóm A và 8 phân nhóm B.
b, Chu kỳ
Chu kỳ là khái niệm để chỉ tập hợp các nguyên tử có cùng số lớp electron. Thông thường các nguyên tố trong chu kỳ thường khác biệt nhau về tính chất vật lý lẫn hóa học (ví dụ như Na và S,...). Tuy nhiên, trường hợp ngoại lệ là ở họ Lantan (chu kỳ 6) và họ Actini (chu kỳ 7), tính tương đồng giữa các nguyên tố được thể hiện rất rõ, đôi khi còn rõ hơn tính tương đồng theo nhóm.
Hiện nay, bảng tuần hoàn có 7 chu kỳ chính, chu kỳ 1 chỉ có 2 nguyên tố, trong khi chu kỳ 7 có đến 32 nguyên tố.
c, Khối
Khối là khái niệm để chỉ tập hợp các nguyên tố có phân lớp electron hóa trị giống nhau. Gồm 4 khối cơ bản:
+ Khối s: 2 nhóm IA và IIA và nguyên tố heli (He).
+ Khối p: các phân nhóm A còn lại (từ IIIA đến VIIIA).
+ Khối d: từ nhóm IIIB đến nhóm IIB, bao gồm tất cả các kim loại chuyển tiếp.
+ Khối f: họ Lantan và họ Actini.
4. Phân loại nguyên tố.
Có nhiều cách để phân loại các nguyên tố trong bảng tuần hoàn. Dưới đây là một vài cách phổ biến:
a, Phân theo trạng thái ở điều kiện chuẩn.
+ Thể rắn: Hầu như toàn bộ kim loại (-Hg, Cn), một số phi kim như P, Si, S.
+ Thể khí: Một số phi kim như O (O2), N (N2), nhóm halogen và nhóm khí trơ.
+ Thể lỏng: thủy ngân (Hg), copernixi (Cn), brom (Br)
b, Phân theo đặc tính lý hóa : bao gồm kim loại, phi kim và á kim.
c, Phân theo phân nhóm : bao gồm nhóm kim loại kiềm (IA), kiềm thổ, (IIA), kim loại chuyển tiếp (các nhóm B), halogen (VIIA), khí trơ (VIIIA).
5. Cấu hình electron
Cấu hình electron là cách bố trí, sắp xếp các electron trên lớp vỏ của nguyên tử. Mỗi nguyên tử đều có một hữu hạn các lớp electron (kí hiệu K,L,M,N,....), mỗi lớp lại gồm các phân lớp khác nhau (s,p.d.f,...). Các electron. Khi số hiệu nguyên tử tăng, số electron sẽ lần lượt lấp đầy các lớp và phân lớp này theo quy tắc Klechkowski (hình bên dưới). Khi một lớp đầy thì các electron sẽ bắt đầu chiếm một lớp mới tương ứng với một chu kỳ mới.

(quy tắc Klechkowski khi viết cấu hình electron nguyên tử)
6. Tính tuần hoàn
a, Tính phi kim, tính kim loại.
- Tính khử của kim loại (hay khả năng nhường electron), gọi tắt là tính kim loại có xu hướng tăng dần trong một nhóm (vì càng nhiều lớp e thì e ở lớp ngoài càng dễ tách ra do lực hấp dẫn và lực tính điện nhỏ hơn), ngược lại, trong một chu kỳ tính kim loại có xu hướng giảm (vì càng nhiều e ở lớp ngoài cùng thì càng khó tách e ra).
- Tính oxi hóa của phi kim (hay khả năng nhận electron), gọi tắt là tính phi kim có xu hướng giảm dần trong một nhóm và tăng dần trong một chu kỳ (giải thích tương tự như tính phi kim).
b, Độ âm điện
Độ âm điện được định nghĩa là khả năng, mức độ hút e của các nguyên tử. Độ âm điện phụ thuộc khá nhiều vào số hiệu nguyên tử và khoảng cách từ e đến hạt nhân. Độ âm điện càng lớn thì khả năng hút e càng mạnh, tương ứng với tính phi kim càng mạnh.
Giống như tính phi kim, độ âm điện có xu hướng tăng dần trong cùng một chu kỳ từ trái qua phải (bỏ qua các khí hiếm) và giảm dần trong cùng một nhóm từ trên xuống dưới. F là nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn, nghĩa là không một nguyên tố nào có thể lấy electron từ F cả.
c, Ái lực electron (xem thêm): là mức năng lượng được tạo ra khi một nguyên tử nhận thêm e vào để trở thành ion âm.
d, Năng lượng ion hóa.
Ngược lại với ái lực electron, năng lượng ion hóa thứ n (IEn) là năng lượng cần thiết để tách electron thứ n ra khỏi nguyên tử trung hòa. Mức năng lượng ion hóa sau luôn lớn hơn mức năng lượng ion hóa đứng trước nó. Ví dụ: năng lượng ion hóa thứ nhất và thứ hai của magiê lần lượt là 738 kJ/mol và 1450 kJ/mol, nhưng năng lượng ion hóa thứ ba, từ Mg2+ xuống Mg3+ đạt tới 7730 kJ/mol.
Xét tính tuần hoàn, năng lượng ion hóa thứ nhất (IE1) giảm dần trong cùng chu kỳ và tăng dần trong cùng một nhóm.
f, Bán kính nguyên tử
Bán kính nguyên tử có xu hướng tăng dần trong cùng một nhóm, nguyên nhân là do số lớp e tăng dần nên bán kính tăng dần. Ngược lại, trong cùng một chu kỳ bán kính nguyên tử giảm dần do lực hấp dẫn và lực tĩnh điện tăng dần làm cho lớp ngoài cùng của nguyên tử đứng sau có xu hướng "co lại" hơn so với các nguyên tử đứng trước.
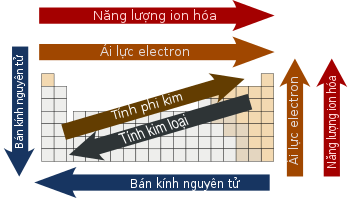
(Sơ lược xu hướng tuần hoàn của các nguyên tố)
Nếu đã là một người học hoá chắc hẳn bạn đã từng biết qua khái niệm "bảng tuần hoàn các nguyên tố hóa học". Chỉ một cái bảng nhỏ thôi cũng đã chứa đựng biết bao quyền năng của môn Hóa rồi!!! Hôm nay, cùng với Nhật tìm hiểu về bảng tuần hoàn thần thánh này nhé!!!

(Bảng tuần hoàn các nguyên tố hóa học)
1. Tác giả (người sáng lập)
Thật ra trong lịch sử, đã có rất nhiều nhà khoa học nghiên cứu và vẽ ra những hệ thống cơ bản của các nguyên tố hóa học như J.L.Meyer, W.Odling, J.Newlands,..... Tuy nhiên, nhắc đến bảng tuần hoàn thì người có công lớn nhất trong việc sáng lập là Dmitri Ivanovich Mendeleev (1834-1907, Nga). Ông là người đã mô tả gần như chính xác thứ tự cũng như tính chất của các nguyên tố.
2. Kích thước.
Bảng tuần hoàn ngày càng mở rộng với sự xuất hiện của rất nhiều các nguyên tố nhân tạo. Hiện nay, bảng tuần hoàn có 118 ô đại diện cho 118 nguyên tố hóa học, trong đó có 98 nguyên tố tự nhiên. Nguyên tố đầu tiên là hidro (Z=1) và nguyên tố cuối cùng được phát hiện là oganesson (Z=118).
3. Cách sắp xêp
a, Nhóm
Nhóm là khái niệm để chỉ tập hợp các nguyên tố có cấu trúc electron tương đồng với nhau (một số tài liệu định nghĩa nhóm là tập hợp các nguyên tố có cùng số electron hóa trị), do đó chúng có các đặc tính gần như giống nhau. Trong bảng tuần hoàn, các nguyên tố trong nhóm được bố trí trong cùng một cột (ngoại trừ nhóm VIIB bao gồm đến 3 cột).
Bảng tuần hoàn bao gồm 16 nhóm trong đó có 8 phân nhóm chính nhóm A và 8 phân nhóm B.
b, Chu kỳ
Chu kỳ là khái niệm để chỉ tập hợp các nguyên tử có cùng số lớp electron. Thông thường các nguyên tố trong chu kỳ thường khác biệt nhau về tính chất vật lý lẫn hóa học (ví dụ như Na và S,...). Tuy nhiên, trường hợp ngoại lệ là ở họ Lantan (chu kỳ 6) và họ Actini (chu kỳ 7), tính tương đồng giữa các nguyên tố được thể hiện rất rõ, đôi khi còn rõ hơn tính tương đồng theo nhóm.
Hiện nay, bảng tuần hoàn có 7 chu kỳ chính, chu kỳ 1 chỉ có 2 nguyên tố, trong khi chu kỳ 7 có đến 32 nguyên tố.
c, Khối
Khối là khái niệm để chỉ tập hợp các nguyên tố có phân lớp electron hóa trị giống nhau. Gồm 4 khối cơ bản:
+ Khối s: 2 nhóm IA và IIA và nguyên tố heli (He).
+ Khối p: các phân nhóm A còn lại (từ IIIA đến VIIIA).
+ Khối d: từ nhóm IIIB đến nhóm IIB, bao gồm tất cả các kim loại chuyển tiếp.
+ Khối f: họ Lantan và họ Actini.
4. Phân loại nguyên tố.
Có nhiều cách để phân loại các nguyên tố trong bảng tuần hoàn. Dưới đây là một vài cách phổ biến:
a, Phân theo trạng thái ở điều kiện chuẩn.
+ Thể rắn: Hầu như toàn bộ kim loại (-Hg, Cn), một số phi kim như P, Si, S.
+ Thể khí: Một số phi kim như O (O2), N (N2), nhóm halogen và nhóm khí trơ.
+ Thể lỏng: thủy ngân (Hg), copernixi (Cn), brom (Br)
b, Phân theo đặc tính lý hóa : bao gồm kim loại, phi kim và á kim.
c, Phân theo phân nhóm : bao gồm nhóm kim loại kiềm (IA), kiềm thổ, (IIA), kim loại chuyển tiếp (các nhóm B), halogen (VIIA), khí trơ (VIIIA).
5. Cấu hình electron
Cấu hình electron là cách bố trí, sắp xếp các electron trên lớp vỏ của nguyên tử. Mỗi nguyên tử đều có một hữu hạn các lớp electron (kí hiệu K,L,M,N,....), mỗi lớp lại gồm các phân lớp khác nhau (s,p.d.f,...). Các electron. Khi số hiệu nguyên tử tăng, số electron sẽ lần lượt lấp đầy các lớp và phân lớp này theo quy tắc Klechkowski (hình bên dưới). Khi một lớp đầy thì các electron sẽ bắt đầu chiếm một lớp mới tương ứng với một chu kỳ mới.

(quy tắc Klechkowski khi viết cấu hình electron nguyên tử)
6. Tính tuần hoàn
a, Tính phi kim, tính kim loại.
- Tính khử của kim loại (hay khả năng nhường electron), gọi tắt là tính kim loại có xu hướng tăng dần trong một nhóm (vì càng nhiều lớp e thì e ở lớp ngoài càng dễ tách ra do lực hấp dẫn và lực tính điện nhỏ hơn), ngược lại, trong một chu kỳ tính kim loại có xu hướng giảm (vì càng nhiều e ở lớp ngoài cùng thì càng khó tách e ra).
- Tính oxi hóa của phi kim (hay khả năng nhận electron), gọi tắt là tính phi kim có xu hướng giảm dần trong một nhóm và tăng dần trong một chu kỳ (giải thích tương tự như tính phi kim).
b, Độ âm điện
Độ âm điện được định nghĩa là khả năng, mức độ hút e của các nguyên tử. Độ âm điện phụ thuộc khá nhiều vào số hiệu nguyên tử và khoảng cách từ e đến hạt nhân. Độ âm điện càng lớn thì khả năng hút e càng mạnh, tương ứng với tính phi kim càng mạnh.
Giống như tính phi kim, độ âm điện có xu hướng tăng dần trong cùng một chu kỳ từ trái qua phải (bỏ qua các khí hiếm) và giảm dần trong cùng một nhóm từ trên xuống dưới. F là nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn, nghĩa là không một nguyên tố nào có thể lấy electron từ F cả.
c, Ái lực electron (xem thêm): là mức năng lượng được tạo ra khi một nguyên tử nhận thêm e vào để trở thành ion âm.
d, Năng lượng ion hóa.
Ngược lại với ái lực electron, năng lượng ion hóa thứ n (IEn) là năng lượng cần thiết để tách electron thứ n ra khỏi nguyên tử trung hòa. Mức năng lượng ion hóa sau luôn lớn hơn mức năng lượng ion hóa đứng trước nó. Ví dụ: năng lượng ion hóa thứ nhất và thứ hai của magiê lần lượt là 738 kJ/mol và 1450 kJ/mol, nhưng năng lượng ion hóa thứ ba, từ Mg2+ xuống Mg3+ đạt tới 7730 kJ/mol.
Xét tính tuần hoàn, năng lượng ion hóa thứ nhất (IE1) giảm dần trong cùng chu kỳ và tăng dần trong cùng một nhóm.
f, Bán kính nguyên tử
Bán kính nguyên tử có xu hướng tăng dần trong cùng một nhóm, nguyên nhân là do số lớp e tăng dần nên bán kính tăng dần. Ngược lại, trong cùng một chu kỳ bán kính nguyên tử giảm dần do lực hấp dẫn và lực tĩnh điện tăng dần làm cho lớp ngoài cùng của nguyên tử đứng sau có xu hướng "co lại" hơn so với các nguyên tử đứng trước.

(Sơ lược xu hướng tuần hoàn của các nguyên tố)

