R
riven
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
1, Tính nồng độ mol của CH3COOH, CH3COO- và H+ trong dung dịch CH3COOH 0,043M biết rằng độ điện li
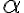 của CH3COOH bằng 20%. Nồng độ của các phân tử và ion trên lần lượt là
của CH3COOH bằng 20%. Nồng độ của các phân tử và ion trên lần lượt là
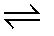 CH3COO- + H+Độ điện li
CH3COO- + H+Độ điện li
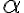 của CH3COOH sẽ giảm khi
của CH3COOH sẽ giảm khi
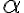
- 0,043; 0,068 và 0,068
- 0,0344; 0,0086 và 0,0086
- 0,0344; 0,0344 và 0,0086 x
- 0,0344; 0,0344 và 0,0344
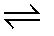
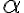
- pha loãng dung dịch.
- nhỏ vào vài giọt dung dịch NaOH.
- nhỏ vào vài giọt NaCl.
- nhỏ vào vài giọt HCl.x
- không đổi
- giảm
- tăng . x
- cả 3 phương án đều sai x

