- 23 Tháng chín 2018
- 576
- 781
- 161
- TP Hồ Chí Minh
- Đại học sư phạm tphcm
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
I. Tính chất vật lí và cấu tạo
- Lưu huỳnh là chất rắn màu vàng, giòn, thực tế không tan trong nước, không thấm nước nhưng tan nhiều trong các dung môi hữu cơ như : rượu, benzen..., dẫn điện và dẫn nhiệt kém.
- Lưu huỳnh có hai dạng thù hình(lưu huỳnh Sα tà phương, lưu huỳnh Sβ đơn tà) và dạng vô định hình (lưu huỳnh dẻo).
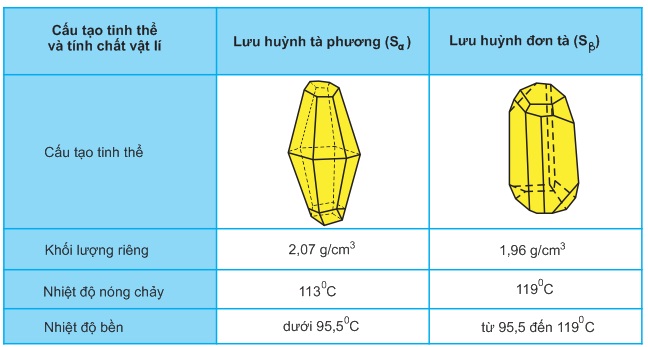
- Lưu huỳnh sôi ở 444,6oC tạo thành hơi màu đỏ nâu. Nếu làm nguội nhanh thì hơi lưu huỳnh chuyển thành bột mịn, gồm những tinh thể nhỏ, gọi là lưu huỳnh hoa.
- Ở trạng thái rắn, mỗi phân tử lưu huỳnh gồm 8 nguyên tử (S8) khép kín thành vòng.
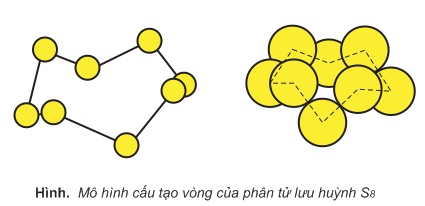
- Do mạng tinh thể lưu huỳnh là mạng phân tử nên lưu huỳnh nóng chảy ở nhiệt độ tương đối thấp 112,8oC, chỉ cao hơp nhiệt độ sôi của nước một ít. Nếu tiếp tục đun nóng đến 187oC lưu huỳnh lỏng trở nên sẫm, có màu vàng nâu và đặc lại, gọi là lưu huỳnh dẻo. Đó là một dạng thù hình của lưu huỳnh. Trong lưu huỳnh dẻo phân tử lưu huỳnh có cấu tạo mạch rất dài giống như phân tử cao su nên lưu huỳnh có tính đàn hồi.
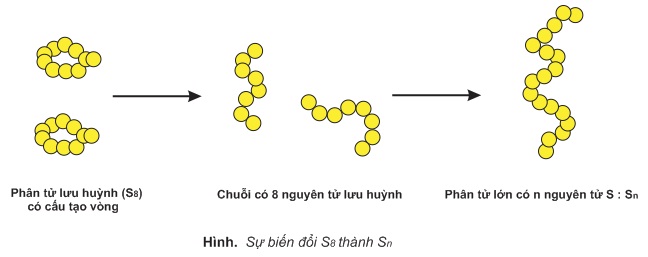
- Như vậy, tồn tại những phân tử lưu huỳnh có thành phần khác nhau. Để đơn giản, ta chỉ viết phân tử lưu huỳnh gồm 1 nguyên tử : S.
II Tính chất hóa học
- Là một phi kim khá hoạt động. Lưu huỳnh vừa thể hiện tính khử vừa thể hiện tính oxi hóa.
1. Thể hiện tính oxi hóa
a. Tác dụng với kim loại.
- Lưu huỳnh dễ tạo ra hợp chất với nhiều kim loại, thường là khi đun nóng.
Ví dụ: Hỗn hợp gồm bột sắt và bột lưu huỳnh nếu được đun nhẹ lúc đầu thì phản ứng xảy ra rất mạnh, toả nhiều nhiệt:
Fe + S → FeS
- Phản ứng giữa lưu huỳnh với nhôm hoặc với kẽm cũng xảy ra mãnh liệt kèm theo sự loé sáng. Những sợi dây đồng mảnh có thể cháy trong hơi lưu huỳnh tạo ra CuS màu đen.
- Thuỷ ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường:
Hg + S → HgS
- Hợp chất của lưu huỳnh với kim loại thuộc loại muối, gọi là sunfua (FeS - sắt sunfua, Al2S3 - nhôm sunfua, .....)
b. Tác dụng với hidro
- Lưu huỳnh cũng phản ứng trực tiếp với hiđro. Khi dẫn hiđro vào ống nghiệm đứng lưu huỳnh đang sôi thì ở đầu ống dẫn khí xuất hiện khí mùi trứng thối, đó là hiđro sunfua:
H2 + S
 H2S
H2S
- Phản ứng này không thực hiện đến cùng.
2. Thể hiện tính khử
a. Tác dụng với phi kim
- Lưu huỳnh tác dụng hầu như với tất cả các phi kim, trừ nitơ và iot.
- Khi bị đốt, lưu huỳnh cháy trong không khí với ngọn lửa màu xanh, tạo ra lưu huỳnh (IV) oxit :
S + O2 → SO2
- Trong các oxit SO2 và SO3, do độ âm điện của lưu huỳnh (2,5) nhỏ hơn của oxi nên liên kết cộng hoá trị giữa oxi và lưu huỳnh là có cực, số oxi hoá của lưu huỳnh trong các oxit đó là +4 và +6.
b. Tác dụng với các chất oxi hóa khác
Thí dụ: 3S + 2KClO3 → 2KCl + 3SO2
S + 6HNO3 (đặc) → H2SO4 + 6NO2 + 2H2O.
* Tóm lại: Trong những phản ứng với kim loại và hiđro thì lưu huỳnh là chất oxi hoá, còn trong phản ứng với phi kim hoạt động hơn, chẳng hạn oxi, hoặc các chất có tính oxi hóa mạnh thì lưu huỳnh là chất khử.
III. Trạng thái tự nhiên
- Lưu huỳnh thuộc loại nguyên tố phổ biến, nó chiếm 0,05% khối lượng vỏ Trái Đất. Trong tự nhiên, lưu huỳnh ở trạng thái tự do (Italia, Mĩ, Nhật Bản, Liên Xô cũ là những nước có mỏ lưu huỳnh lớn) và trong thành phần hợp chất. Những quặng chứa lưu huỳnh là : pirit FeS2, xfalerit SnS, galen PbS, muối Na2SO4.10H2O, thạch cao CaSO4.2H2O, muối chát MgSO4.7H2O. Lưu huỳnh cũng có trong cơ thể động vật và thực vật (trong thành phần của protein).
IV Điều chế
- Trong công nghiệp, lưu huỳnh được khai thác từ mỏ lưu huỳnh (tồn tại ở dạng tự do).
V Ứng dụng

- Lưu huỳnh có nhiều ứng dụng. Trong công nghiệp, lưu huỳnh được dùng chủ yếu để sản xuất axit sunfuric. Một lượng lớn lưu huỳnh dùng để luyện cao su : nó làm tăng độ bền chắc và tính đàn hồi của cao su. Nếu cho nhiều lưu huỳnh vào cao su thì được chất dẻo ebonit dùng làm chất cách điện. Lưu huỳnh còn được dùng để trừ sâu cho một số loại cây, để chế thuốc súng đen, thuốc đầu que diêm, chế mỡ chữa bệnh ngoài da v.v...
- Lưu huỳnh là chất rắn màu vàng, giòn, thực tế không tan trong nước, không thấm nước nhưng tan nhiều trong các dung môi hữu cơ như : rượu, benzen..., dẫn điện và dẫn nhiệt kém.
- Lưu huỳnh có hai dạng thù hình(lưu huỳnh Sα tà phương, lưu huỳnh Sβ đơn tà) và dạng vô định hình (lưu huỳnh dẻo).

- Lưu huỳnh sôi ở 444,6oC tạo thành hơi màu đỏ nâu. Nếu làm nguội nhanh thì hơi lưu huỳnh chuyển thành bột mịn, gồm những tinh thể nhỏ, gọi là lưu huỳnh hoa.
- Ở trạng thái rắn, mỗi phân tử lưu huỳnh gồm 8 nguyên tử (S8) khép kín thành vòng.

- Do mạng tinh thể lưu huỳnh là mạng phân tử nên lưu huỳnh nóng chảy ở nhiệt độ tương đối thấp 112,8oC, chỉ cao hơp nhiệt độ sôi của nước một ít. Nếu tiếp tục đun nóng đến 187oC lưu huỳnh lỏng trở nên sẫm, có màu vàng nâu và đặc lại, gọi là lưu huỳnh dẻo. Đó là một dạng thù hình của lưu huỳnh. Trong lưu huỳnh dẻo phân tử lưu huỳnh có cấu tạo mạch rất dài giống như phân tử cao su nên lưu huỳnh có tính đàn hồi.

- Như vậy, tồn tại những phân tử lưu huỳnh có thành phần khác nhau. Để đơn giản, ta chỉ viết phân tử lưu huỳnh gồm 1 nguyên tử : S.
II Tính chất hóa học
- Là một phi kim khá hoạt động. Lưu huỳnh vừa thể hiện tính khử vừa thể hiện tính oxi hóa.
1. Thể hiện tính oxi hóa
a. Tác dụng với kim loại.
- Lưu huỳnh dễ tạo ra hợp chất với nhiều kim loại, thường là khi đun nóng.
Ví dụ: Hỗn hợp gồm bột sắt và bột lưu huỳnh nếu được đun nhẹ lúc đầu thì phản ứng xảy ra rất mạnh, toả nhiều nhiệt:
Fe + S → FeS
- Phản ứng giữa lưu huỳnh với nhôm hoặc với kẽm cũng xảy ra mãnh liệt kèm theo sự loé sáng. Những sợi dây đồng mảnh có thể cháy trong hơi lưu huỳnh tạo ra CuS màu đen.
- Thuỷ ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường:
Hg + S → HgS
- Hợp chất của lưu huỳnh với kim loại thuộc loại muối, gọi là sunfua (FeS - sắt sunfua, Al2S3 - nhôm sunfua, .....)
b. Tác dụng với hidro
- Lưu huỳnh cũng phản ứng trực tiếp với hiđro. Khi dẫn hiđro vào ống nghiệm đứng lưu huỳnh đang sôi thì ở đầu ống dẫn khí xuất hiện khí mùi trứng thối, đó là hiđro sunfua:
H2 + S
- Phản ứng này không thực hiện đến cùng.
2. Thể hiện tính khử
a. Tác dụng với phi kim
- Lưu huỳnh tác dụng hầu như với tất cả các phi kim, trừ nitơ và iot.
- Khi bị đốt, lưu huỳnh cháy trong không khí với ngọn lửa màu xanh, tạo ra lưu huỳnh (IV) oxit :
S + O2 → SO2
- Trong các oxit SO2 và SO3, do độ âm điện của lưu huỳnh (2,5) nhỏ hơn của oxi nên liên kết cộng hoá trị giữa oxi và lưu huỳnh là có cực, số oxi hoá của lưu huỳnh trong các oxit đó là +4 và +6.
b. Tác dụng với các chất oxi hóa khác
Thí dụ: 3S + 2KClO3 → 2KCl + 3SO2
S + 6HNO3 (đặc) → H2SO4 + 6NO2 + 2H2O.
* Tóm lại: Trong những phản ứng với kim loại và hiđro thì lưu huỳnh là chất oxi hoá, còn trong phản ứng với phi kim hoạt động hơn, chẳng hạn oxi, hoặc các chất có tính oxi hóa mạnh thì lưu huỳnh là chất khử.
III. Trạng thái tự nhiên
- Lưu huỳnh thuộc loại nguyên tố phổ biến, nó chiếm 0,05% khối lượng vỏ Trái Đất. Trong tự nhiên, lưu huỳnh ở trạng thái tự do (Italia, Mĩ, Nhật Bản, Liên Xô cũ là những nước có mỏ lưu huỳnh lớn) và trong thành phần hợp chất. Những quặng chứa lưu huỳnh là : pirit FeS2, xfalerit SnS, galen PbS, muối Na2SO4.10H2O, thạch cao CaSO4.2H2O, muối chát MgSO4.7H2O. Lưu huỳnh cũng có trong cơ thể động vật và thực vật (trong thành phần của protein).
IV Điều chế
- Trong công nghiệp, lưu huỳnh được khai thác từ mỏ lưu huỳnh (tồn tại ở dạng tự do).
V Ứng dụng

- Lưu huỳnh có nhiều ứng dụng. Trong công nghiệp, lưu huỳnh được dùng chủ yếu để sản xuất axit sunfuric. Một lượng lớn lưu huỳnh dùng để luyện cao su : nó làm tăng độ bền chắc và tính đàn hồi của cao su. Nếu cho nhiều lưu huỳnh vào cao su thì được chất dẻo ebonit dùng làm chất cách điện. Lưu huỳnh còn được dùng để trừ sâu cho một số loại cây, để chế thuốc súng đen, thuốc đầu que diêm, chế mỡ chữa bệnh ngoài da v.v...

