- 23 Tháng chín 2018
- 576
- 782
- 161
- TP Hồ Chí Minh
- Đại học sư phạm tphcm
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
I. ĐƠN CHẤT HALOGEN
1. Vị trí của nhóm halogen trong bảng tuần hoàn
- Nhóm halogen: nhóm VIIA.
- Nhóm halogen: gồm Flo (F), Clo (Cl), Brom (Br) và Iot (I).
Một số đặc điểm của các halogen
2. Tính chất vật lí
- Trạng thái và màu sắc: Flo (khí, lục nhạt), Clo (khí, vàng lục), Brom (lỏng, đỏ nâu) và Iot (rắn, đen tím, dễ thăng hoa).

Flo

Clo

Iot
- Từ flo đến iot, nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Flo không tan trong nước, các halogen khác tan tương đối ít trong nước và tan nhiều trong một số dung môi hữu cơ.
3. Cấu hình e nguyên tử và cấu tạo phân tử của các halogen
- Cấu hình e lớp ngoài cùng: ns2np5.
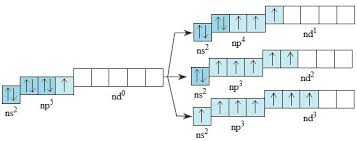
Cấu hình e ở trạng thái kích thích của Cl, Br và I
- Công thức đơn chất: X2: (F2, Cl2, Br2, I2).
- Cấu tạo phân tử: X - X. Liên kết trong phân tử đơn chất halogen là liên kết cộng hóa trị không phân cực.
4. Khái quát về tính chất hóa học của các halogen
- Do lớp e ngoài cùng đã có 7e nên halogen là những phi kim điển hình, dễ nhận thêm 1e thể hiện tính oxi hóa mạnh.
- Tính oxi hóa của các halogen giảm dần khi đi từ F2 đến I2.
- Trong các hợp chất, F chỉ có mức oxi hóa -1; các halogen khác ngoài mức oxi hóa -1 còn có mức +1; +3; +5; +7.
5. Các phản ứng minh họa tính chất hóa học của đơn chất halogen
a. Tác dụng với kim loại
- Các halogen phản ứng với hầu hết các kim loại trừ Au và Pt (riêng F2 phản ứng được với tất cả các kim loại) → muối halogenua. Các phản ứng thường xảy ra ở nhiệt độ cao.
2M + nX2 → 2MXn
Muối thu được thường ứng với mức hóa trị cao nhất của kim loại. Riêng phản ứng của Fe với I2 chỉ tạo sản phẩm là FeI2.
b. Phản ứng với hiđro tạo thành hiđro halogenua
H2 + X2 → 2HX
- Các halogen tham gia phản ứng cộng H2 với điều kiện khác nhau:
+ F2: phản ứng được ngay cả trong bóng tối.
+ Cl2: phản ứng khi được chiếu sáng.
+ Br2: phản ứng xảy ra khi được đun nóng ở nhiệt độ cao.
+ I2: phản ứng có tính thuận nghịch và phải được đun nóng.
- Điều kiện phản ứng với H2 phức tạp dần khi đi từ F2 đến I2 nên phản ứng với H2 có thể chứng minh tính oxi hóa trong nhóm halogen giảm dần từ F2 đến I2.
c. Tác dụng với nước
- F2 tác dụng mãnh liệt với nước:
2H2O + 2F2 → 4HF + O2
→ Phản ứng chứng minh F2 có tính oxi hóa mạnh hơn của O2.
- Br2 và Cl2 có phản ứng thuận nghịch với nước:
H2O + X2 ↔ HX + HXO (axit halogen hiđric và axit hipohalogenơ)
H2O + Cl2 ↔ HCl + HClO
Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO HCl + O. Vì HClO có chứa ion ClO- có tính oxi hóa mạnh nên có thể dùng nước Clo để tẩy màu hoặc sát trùng.
- I2 không phản ứng với nước.
d. Phản ứng với dung dịch kiềm
- Nếu dung dịch kiềm loãng nguội:
X2 + 2NaOH → NaX + NaXO + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
(nước Javen)
2Cl2 + 2Ca(OH)2 dung dịch → CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + Ca(OH)2 bột → CaOCl2 + H2O
(clorua vôi)
Riêng F2:
2F2 + 2NaOH → 2NaF + H2O + OF2
- Nếu dung dịch kiềm đặc nóng:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1000C)
e. Tác dụng với dung dịch muối halogenua của halogen có tính oxi hóa yếu hơn
(F2 không có phản ứng này)
X2 + 2NaX’ → 2NaX + X’2
(trong đó X’ là halogen có tính oxi hóa yếu hơn tính oxi hóa của halogen X).
Các cặp oxi hóa - khử của halogen được xếp theo chiều giảm dần tính khử của các ion X-: I2/2I- > Br2/2Br- > Cl2/2Cl-
Trong nước:
5Cl2 + 6H2O + Br2 → 10HCl + 2HBrO3
g. Một số phản ứng khác
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
Br2 + SO2 + 2H2O → 2HBr + H2SO4
I2 kết hợp với hồ tinh bột → hợp chất màu xanh tím.
Chú ý
Trong phản ứng với kim loại và với H2, với dung dung dịch muối của các halogen yếu hơn, halogen là chất oxi hóa. Còn trong phản ứng với nước và dung dịch kiềm, các halogen vừa là chất khử, vừa là chất oxi hóa.
6. Điều chế
a. Điện phân muối halogenua
- Điện phân nóng chảy:
2MXn → 2M + nX2 (M là kim loại kiềm: Na, K; X thường là: Cl, Br, I).
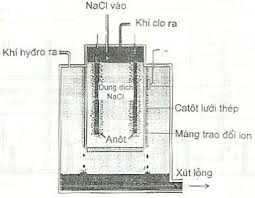
- Điện phân dung dịch muối halogenua của kim loại kiềm có màng ngăn:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
b. Cho HX tác dụng với các chất oxi hóa mạnh (thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3).
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
KClO3 + 6HCl → 3H2O + KCl + 3Cl2
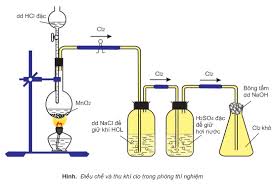
Thường gặp câu hỏi so sánh lượng clo sinh ra khi dùng cùng một lượng HCl hoặc chất oxi hóa…
7. Ứng dụng
a. Ứng dụng của clo
- Dùng làm chất sát trùng trong hệ thống cung cấp nước sạch, khi xử lí nước thải.
- Tẩu trắng vải, sợi, giấy.
- Là nguyên liệu để sản xuất nhiều hợp chất hữu cơ và vô cơ.

Ứng dụng của clo
b. Ứng dụng của flo
- Làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa.
- Dùng trong công nghiệp sản xuất nhiên liệu hạt nhân để làm giàu 235U.
- Ứng dụng quan trọng của flo là ở dạng dẫn xuất:
+ Dẫn xuất halogen của flo có nhiều ứng dụng: teflon (-CF2-CF2-)n là chất dẻo chịu được axit, kiềm và nhiều hóa chất khác; Freon (chủ yếu là CFCl3 và CF2Cl2) đường dùng trong các tủ lạnh và máy lạnh...
+ NaF được dùng làm thuốc chống sâu răng.
c. Ứng dụng của brom
- Chế tạo dược phẩm, phẩm nhuộm...
- Dùng để chế tạo AgBr là chất nhạy cảm với ánh sáng để tráng lên phim ảnh.
d. Ứng dụng của iot
- Dùng chủ yếu ở dạng cồn iot làm chất sát trùng.
- Có trong thành phần của nhiêu dược phẩm.
- Trộn KI và KIO3 vào muối ăn tạo ra muối iot.
8. Trạng thái tự nhiên
Chỉ tồn tại ở dạng hợp chất:
- Clo chủ yếu tồn tại ở dạng muối clorua, quan trọng nhất là NaCl. NaCl có trong nước biển và đại dương. NaCl được tìm thấy ở trạng thái rắn gọi là muoosimor. KCl cũng khá phổ biến, nó có trong khoáng vật cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
- Flo có trong men răng của người và động vật, trong lá của một số loại cây. Phần lớn có trong 2 loại khoáng vật là florit (CaF2) và criolit (Na3AlF6 hay AlF3.3NaF).
- Brom chủ yếu có trong muối bromua của kali, natri, magie. Bromua kim loại có trong nước biển, nước của một số hồ cùng với muối clorua.
- Hợp chất của iot có trong nước biển nhưng ít. Iot được tích trong các mô của một số loại rong biển. Nó còn có trong tuyến giáp của người
II. HỢP CHẤT CỦA HALOGEN
1. Hiđrohalogenua (HX)
- Tất cả đều là chất khí, tan nhiều trong nước, điện li hoàn toàn (trừ HF) tạo thành dung dịch axit mạnh.
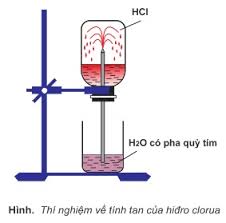
- Thứ tự tính axit và tính khử tăng dần: HF < HCl < HBr < HI
- Tính axit mạnh của HCl, HBr và HI:
+ Làm quỳ tím chuyển thành màu đỏ.
+ Tác dụng với kim loại đứng trước H → muối trong đó kim loại có hóa trị thấp + H2.
Fe + 2HCl → FeCl2 + H2
+ Tác dụng với oxit kim loại → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
HI + muối sắt (III) → muối sắt (II) + I2
+ Tác dụng với bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
+ Tác dụng với muối → muối mới + axit mới
Na2CO3 + 2HBr → 2NaBr + H2O + CO2
- Tính khử thể hiện khi tác dụng với các chất oxi hóa mạnh (xem phần điều chế clo).
- HF có tính chất riêng là ăn mòn thủy tinh:
4HF + SiO2 → SiF4 + 2H2O
- Điều chế:
+ Phương pháp sunfat (trong phòng thí nghiệm): (HBr và HI không dùng được cách này do có tính khử)
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl (< 2500C)
2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl (> 4000C)
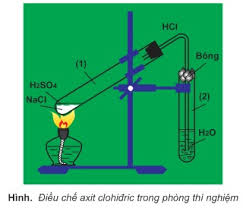
+ Phương pháp tổng hợp (trong công nghiệp):
H2 + Cl2 → 2HCl (ánh sáng, nhiệt độ cao)
HF được điều chế nhờ phản ứng:
CaF2 + H2SO4 → CaSO4 + 2HF ở 2500C
2. Muối halogenua
- Muối của axit halogen hidric được gọi là muối halogenua.
- Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2Cl2. Tính tan của muối bromua và iođua tương tự clorua.
- Để nhận biết ion X- có thể dùng thuốc thử là dung dịch AgNO3:
+ AgF tan trong dung dịch.
+ AgCl kết tủa trắng (AgCl tan trong dung dịch amoniac do tạo phức với NH3).

AgCl
+ AgBr kết tủa vàng nhạt (không tan trong NH3 dư)
+ AgI kết tủa vàng đậm (không tan trong NH3 dư)

AgI
- Các muối AgX kết tủa thường dễ bị phân hủy bởi nhiệt hoặc ánh sáng: 2AgX → 2Ag + X2
3. HClO (axit hipoclorơ)
- Là axit rất yếu, yếu hơn cả axit cacbonic:
CO2 + H2O + KClO → KHCO3 + HClO
- Kém bền, chỉ tồn tại được trong dung dịch nước:
HClO → HCl + O
- HClO và muối của nó đều có tính oxi hóa rất mạnh.
4. HClO3 (axit cloric) và muối clorat
a. HClO3
- Là axit khá mạnh, tan nhiều trong nước, có tính oxi hóa mạnh.
- Điều chế bằng cách nhiệt phân HClO:
3HClO → HClO3 + 2HCl.
b. Muối kali clorat
- Muối KClO3 được dùng làm thuốc nổ, diêm tiêu:
6P + 5KClO3 → 3P2O5 + 5KCl
- Nhiệt phân KClO3:
+ Nếu có xúc tác MnO2:
2KClO3 → 2KCl + 3O2
+ Nếu không có xúc tác MnO2:
4KClO3 → 3KClO4 + KCl
5. HClO4 (axit pecloric)
- Là axit rất mạnh, tan nhiều trong nước. Phản ứng loại nước từ HClO4 có mặt P2O5 → Cl2O7.
2HClO4 → Cl2O7 + H2O
- Điều chế từ KClO4
KClO4 + H2SO4 → HClO4 + KHSO4
Chú ý: Từ HClO đến HClO2,HClO3, HClO4: Tính axit và tính bền tăng, tính oxi hóa giảm.
1. Vị trí của nhóm halogen trong bảng tuần hoàn
- Nhóm halogen: nhóm VIIA.
- Nhóm halogen: gồm Flo (F), Clo (Cl), Brom (Br) và Iot (I).
Một số đặc điểm của các halogen
2. Tính chất vật lí
- Trạng thái và màu sắc: Flo (khí, lục nhạt), Clo (khí, vàng lục), Brom (lỏng, đỏ nâu) và Iot (rắn, đen tím, dễ thăng hoa).

Flo

Clo


Iot
- Từ flo đến iot, nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Flo không tan trong nước, các halogen khác tan tương đối ít trong nước và tan nhiều trong một số dung môi hữu cơ.
3. Cấu hình e nguyên tử và cấu tạo phân tử của các halogen
- Cấu hình e lớp ngoài cùng: ns2np5.

Cấu hình e ở trạng thái kích thích của Cl, Br và I
- Công thức đơn chất: X2: (F2, Cl2, Br2, I2).
- Cấu tạo phân tử: X - X. Liên kết trong phân tử đơn chất halogen là liên kết cộng hóa trị không phân cực.
4. Khái quát về tính chất hóa học của các halogen
- Do lớp e ngoài cùng đã có 7e nên halogen là những phi kim điển hình, dễ nhận thêm 1e thể hiện tính oxi hóa mạnh.
- Tính oxi hóa của các halogen giảm dần khi đi từ F2 đến I2.
- Trong các hợp chất, F chỉ có mức oxi hóa -1; các halogen khác ngoài mức oxi hóa -1 còn có mức +1; +3; +5; +7.
5. Các phản ứng minh họa tính chất hóa học của đơn chất halogen
a. Tác dụng với kim loại
- Các halogen phản ứng với hầu hết các kim loại trừ Au và Pt (riêng F2 phản ứng được với tất cả các kim loại) → muối halogenua. Các phản ứng thường xảy ra ở nhiệt độ cao.
2M + nX2 → 2MXn
Muối thu được thường ứng với mức hóa trị cao nhất của kim loại. Riêng phản ứng của Fe với I2 chỉ tạo sản phẩm là FeI2.

b. Phản ứng với hiđro tạo thành hiđro halogenua
H2 + X2 → 2HX
- Các halogen tham gia phản ứng cộng H2 với điều kiện khác nhau:
+ F2: phản ứng được ngay cả trong bóng tối.
+ Cl2: phản ứng khi được chiếu sáng.
+ Br2: phản ứng xảy ra khi được đun nóng ở nhiệt độ cao.
+ I2: phản ứng có tính thuận nghịch và phải được đun nóng.
- Điều kiện phản ứng với H2 phức tạp dần khi đi từ F2 đến I2 nên phản ứng với H2 có thể chứng minh tính oxi hóa trong nhóm halogen giảm dần từ F2 đến I2.
c. Tác dụng với nước
- F2 tác dụng mãnh liệt với nước:
2H2O + 2F2 → 4HF + O2
→ Phản ứng chứng minh F2 có tính oxi hóa mạnh hơn của O2.
- Br2 và Cl2 có phản ứng thuận nghịch với nước:
H2O + X2 ↔ HX + HXO (axit halogen hiđric và axit hipohalogenơ)
H2O + Cl2 ↔ HCl + HClO
Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO HCl + O. Vì HClO có chứa ion ClO- có tính oxi hóa mạnh nên có thể dùng nước Clo để tẩy màu hoặc sát trùng.
- I2 không phản ứng với nước.
d. Phản ứng với dung dịch kiềm
- Nếu dung dịch kiềm loãng nguội:
X2 + 2NaOH → NaX + NaXO + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
(nước Javen)
2Cl2 + 2Ca(OH)2 dung dịch → CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + Ca(OH)2 bột → CaOCl2 + H2O
(clorua vôi)
Riêng F2:
2F2 + 2NaOH → 2NaF + H2O + OF2
- Nếu dung dịch kiềm đặc nóng:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1000C)
e. Tác dụng với dung dịch muối halogenua của halogen có tính oxi hóa yếu hơn
(F2 không có phản ứng này)
X2 + 2NaX’ → 2NaX + X’2
(trong đó X’ là halogen có tính oxi hóa yếu hơn tính oxi hóa của halogen X).
Các cặp oxi hóa - khử của halogen được xếp theo chiều giảm dần tính khử của các ion X-: I2/2I- > Br2/2Br- > Cl2/2Cl-
Trong nước:
5Cl2 + 6H2O + Br2 → 10HCl + 2HBrO3
g. Một số phản ứng khác
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
Br2 + SO2 + 2H2O → 2HBr + H2SO4
I2 kết hợp với hồ tinh bột → hợp chất màu xanh tím.
Chú ý
Trong phản ứng với kim loại và với H2, với dung dung dịch muối của các halogen yếu hơn, halogen là chất oxi hóa. Còn trong phản ứng với nước và dung dịch kiềm, các halogen vừa là chất khử, vừa là chất oxi hóa.
6. Điều chế
a. Điện phân muối halogenua
- Điện phân nóng chảy:
2MXn → 2M + nX2 (M là kim loại kiềm: Na, K; X thường là: Cl, Br, I).
- Điện phân dung dịch muối halogenua của kim loại kiềm có màng ngăn:
2NaCl + 2H2O → H2 + 2NaOH + Cl2

b. Cho HX tác dụng với các chất oxi hóa mạnh (thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3).
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
KClO3 + 6HCl → 3H2O + KCl + 3Cl2

Thường gặp câu hỏi so sánh lượng clo sinh ra khi dùng cùng một lượng HCl hoặc chất oxi hóa…
7. Ứng dụng
a. Ứng dụng của clo
- Dùng làm chất sát trùng trong hệ thống cung cấp nước sạch, khi xử lí nước thải.
- Tẩu trắng vải, sợi, giấy.
- Là nguyên liệu để sản xuất nhiều hợp chất hữu cơ và vô cơ.

Ứng dụng của clo
b. Ứng dụng của flo
- Làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa.
- Dùng trong công nghiệp sản xuất nhiên liệu hạt nhân để làm giàu 235U.
- Ứng dụng quan trọng của flo là ở dạng dẫn xuất:
+ Dẫn xuất halogen của flo có nhiều ứng dụng: teflon (-CF2-CF2-)n là chất dẻo chịu được axit, kiềm và nhiều hóa chất khác; Freon (chủ yếu là CFCl3 và CF2Cl2) đường dùng trong các tủ lạnh và máy lạnh...
+ NaF được dùng làm thuốc chống sâu răng.
c. Ứng dụng của brom
- Chế tạo dược phẩm, phẩm nhuộm...
- Dùng để chế tạo AgBr là chất nhạy cảm với ánh sáng để tráng lên phim ảnh.
d. Ứng dụng của iot
- Dùng chủ yếu ở dạng cồn iot làm chất sát trùng.
- Có trong thành phần của nhiêu dược phẩm.
- Trộn KI và KIO3 vào muối ăn tạo ra muối iot.
8. Trạng thái tự nhiên
Chỉ tồn tại ở dạng hợp chất:
- Clo chủ yếu tồn tại ở dạng muối clorua, quan trọng nhất là NaCl. NaCl có trong nước biển và đại dương. NaCl được tìm thấy ở trạng thái rắn gọi là muoosimor. KCl cũng khá phổ biến, nó có trong khoáng vật cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
- Flo có trong men răng của người và động vật, trong lá của một số loại cây. Phần lớn có trong 2 loại khoáng vật là florit (CaF2) và criolit (Na3AlF6 hay AlF3.3NaF).
- Brom chủ yếu có trong muối bromua của kali, natri, magie. Bromua kim loại có trong nước biển, nước của một số hồ cùng với muối clorua.
- Hợp chất của iot có trong nước biển nhưng ít. Iot được tích trong các mô của một số loại rong biển. Nó còn có trong tuyến giáp của người
II. HỢP CHẤT CỦA HALOGEN
1. Hiđrohalogenua (HX)
- Tất cả đều là chất khí, tan nhiều trong nước, điện li hoàn toàn (trừ HF) tạo thành dung dịch axit mạnh.

- Thứ tự tính axit và tính khử tăng dần: HF < HCl < HBr < HI
- Tính axit mạnh của HCl, HBr và HI:
+ Làm quỳ tím chuyển thành màu đỏ.
+ Tác dụng với kim loại đứng trước H → muối trong đó kim loại có hóa trị thấp + H2.
Fe + 2HCl → FeCl2 + H2
+ Tác dụng với oxit kim loại → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
HI + muối sắt (III) → muối sắt (II) + I2
+ Tác dụng với bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
+ Tác dụng với muối → muối mới + axit mới
Na2CO3 + 2HBr → 2NaBr + H2O + CO2
- Tính khử thể hiện khi tác dụng với các chất oxi hóa mạnh (xem phần điều chế clo).
- HF có tính chất riêng là ăn mòn thủy tinh:
4HF + SiO2 → SiF4 + 2H2O
- Điều chế:
+ Phương pháp sunfat (trong phòng thí nghiệm): (HBr và HI không dùng được cách này do có tính khử)
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl (< 2500C)
2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl (> 4000C)

+ Phương pháp tổng hợp (trong công nghiệp):
H2 + Cl2 → 2HCl (ánh sáng, nhiệt độ cao)
HF được điều chế nhờ phản ứng:
CaF2 + H2SO4 → CaSO4 + 2HF ở 2500C
2. Muối halogenua
- Muối của axit halogen hidric được gọi là muối halogenua.
- Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2Cl2. Tính tan của muối bromua và iođua tương tự clorua.
- Để nhận biết ion X- có thể dùng thuốc thử là dung dịch AgNO3:
+ AgF tan trong dung dịch.
+ AgCl kết tủa trắng (AgCl tan trong dung dịch amoniac do tạo phức với NH3).

AgCl
+ AgBr kết tủa vàng nhạt (không tan trong NH3 dư)
+ AgI kết tủa vàng đậm (không tan trong NH3 dư)

AgI
- Các muối AgX kết tủa thường dễ bị phân hủy bởi nhiệt hoặc ánh sáng: 2AgX → 2Ag + X2
3. HClO (axit hipoclorơ)
- Là axit rất yếu, yếu hơn cả axit cacbonic:
CO2 + H2O + KClO → KHCO3 + HClO
- Kém bền, chỉ tồn tại được trong dung dịch nước:
HClO → HCl + O
- HClO và muối của nó đều có tính oxi hóa rất mạnh.
4. HClO3 (axit cloric) và muối clorat
a. HClO3
- Là axit khá mạnh, tan nhiều trong nước, có tính oxi hóa mạnh.
- Điều chế bằng cách nhiệt phân HClO:
3HClO → HClO3 + 2HCl.
b. Muối kali clorat
- Muối KClO3 được dùng làm thuốc nổ, diêm tiêu:
6P + 5KClO3 → 3P2O5 + 5KCl
- Nhiệt phân KClO3:
+ Nếu có xúc tác MnO2:
2KClO3 → 2KCl + 3O2
+ Nếu không có xúc tác MnO2:
4KClO3 → 3KClO4 + KCl
5. HClO4 (axit pecloric)
- Là axit rất mạnh, tan nhiều trong nước. Phản ứng loại nước từ HClO4 có mặt P2O5 → Cl2O7.
2HClO4 → Cl2O7 + H2O
- Điều chế từ KClO4
KClO4 + H2SO4 → HClO4 + KHSO4
Chú ý: Từ HClO đến HClO2,HClO3, HClO4: Tính axit và tính bền tăng, tính oxi hóa giảm.

