- 25 Tháng mười 2018
- 1,560
- 1,684
- 251
- 29
- Quảng Bình
- Đại học Sư phạm Huế
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chào các bạn, năm học mới sắp bắt đầu. Để học tốt kiến thức hóa học 10 thì nền tảng kiến thức THCS của các bạn phải vững. Vì vậy hôm nay mình chia sẻ bài viết tổng ôn lý thuyết hóa học 9. Bài viết có thể chưa được đầy đủ và còn thiếu sót. Rất mong nhận được sự góp ý từ các bạn
I – MỐI QUAN HỆ GIỮA CÁC LOẠI HỢP CHẤT VÔ CƠ
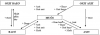
II CÁC LOẠI HỢP CHẤT VÔ CƠ:
1. OXIT
a) Định nghĩa: Oxit là hợp chất gồm 2 nguyên tố, trong đó có một nguyên tố là oxi.
Vd: CaO, SO2, CO, Na2O, Fe3O4, P2O5, …
b) Tính chất hóa học
[TBODY]
[/TBODY]2. AXIT
a) Định nghĩa: Axit là hợp chất mà phân tử gồm có một hay nhiều nguyên tử H liên kết với gốc axit. Các nguyên tử H này có thể thay thế bằng các ng/tử kim loại.
Vd: HCl, HNO3, H2SO4, H3PO4, …
b) Tính chất hóa học:
- Làm đổi màu chất chỉ thị: Quì tím hóa đỏ
- Tác dụng với kim loại (trước H trong dãy hoạt động hóa học)
Fe + 2HCl → FeCl2 + H2
Cu + HCl → (không phản ứng)
Lưu ý: HNO3 và H2SO4 đặc nóng tác dụng với hầu hết các kim loại (trừ Au, Pt), sản phẩm phản ứng không giải phóng H2.
Al, Fe, Cr bị thụ động hóa trong HNO3 và H2SO4 đặc nguội.
- Tác dụng với oxit bazơ
CuO + 2HCl → CuCl2 + H2O
- Tác dụng với bazơ
NaOH + HCl → NaCl + H2O
- Tác dụng với dung dịch muối
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
Điều kiện phản ứng: Có chất không tan hoặc chất khí tạo thành.
3. BAZƠ
a) Định nghĩa: Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (OH).
Vd: KOH, NaOH, Ba(OH)2, Al(OH)3, …
b) Tính chất hóa học:
- Đổi màu chất chỉ thị, cụ thể:
+ Quì tím hóa xanh
+ Phenolphtalein hóa hồng
- Tác dụng với axit
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
- Tác dụng với oxit axit
Na2O + CO2 → Na2CO3
- Tác dụng với dung dịch muối
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
KOH + NaCl → không phản ứng
Điều kiện: Có chất kết tủa hoặc chất khí tạo thành sau phản ứng.
- Phản ứng nhiệt phân
Fe(OH)3 →(to) Fe2O3 + 3H2O
4. MUỐI
a) Định nghĩa: Muối là hợp chất mà phân tử có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit. Vd: NaCl, MgSO4, Fe(NO3)2, BaCO3, …
b) Tính chất hóa học:
- Tác dụng với kim loại → muối mới + kim loại mới
Fe + CuSO4 → FeSO4 + Cu
Lưu ý: Chỉ kim loại đứng trước (trừ Na, K, Ba, Ca) mới đẩy được KL đứng sau ra khỏi dung
- Tác dụng với axit → muối mới + axit mới
NaHCO3 + HCl → NaCl + CO2↑ + H2O
Đk: có chất khí hoặc kết tủa tạo thành
- Tác dụng với dung dịch bazơ → muối mới + bazơ mới
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Đk: Có chất kết tủa hoặc chất khí tạo thành.
- Tác dụng với muối → muối mới + muối mới
AgNO3 + NaCl →AgCl↓ + NaNO3
NaHCO3 + NaHSO4 → Na2SO4 + CO2 + H2O
· PHẢN ỨNG TRUNG HÒA
Phản ứng giữa axít và bazơ được gọi là phản ứng trung hòa, sản phẩm của phản ứng này là muối và nước
· PHẢN ỨNG TRAO ĐỔI
- Định nghĩa: Là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
Vd: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
NaCl + AgNO3 → AgCl↓ + NaNO3
III – KIM LOẠI:
1. TÍNH CHẤT CHUNG CỦA KIM LOẠI
2. a) Tính chất vật lý:
- Có tính dẻo, dễ dát mỏng và dễ kéo sợi.
- Dẫn điện và dẫn nhiệt tốt. (Ag là kim loại dẫn điện và dẫn nhiệt tốt nhất, tiếp theo là Cu, Al, Fe, …)
- Có ánh kim.
b) Tính chất hóa học:
- Tác dụng với phi kim: Phản ứng thường xảy ra ở nhiệt độ cao
+ T/d với oxi → (to) oxit
VD: 3Fe + 2O2 → (to) Fe3O4
+ Tác dụng với phi kim khác (Cl2, S, …) → muối
VD: 2Na + Cl2 → (to) 2NaCl
- Tác dụng với dung dịch axit → muối + H2
VD: Fe + 2HCl → FeCl2 + H2
Lưu ý: KL đứng trước H trong dãy hoạt động hóa học
- Tác dụng với nước → dd bazơ (Lưu ý: chỉ có một số KL như Na, K, Ba, Ca)
VD: 2Na + H2O → 2NaOH
- Tác dụng với muối → Muối mới + KL mới
VD: Fe + CuSO4 → FeSO4 + Cu
Lưu ý: Chỉ kim loại đứng trước (trừ Na, K, Ba, Ca) mới đẩy được KL đứng sau ra khỏi dung dịch muối
· DÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI
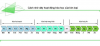
V – PHI KIM:
1. TÍNH CHẤT CHUNG CỦA PHI KIM a) Tính chất vật lý:
Ở điều kiện thường, phi kim tồn tại ở cả 3 trạng thái: rắn (S, P, ...) ; lỏng (Br2) ; khí (Cl2, O2, N2, H2, ...). - Phần lớn các nguyên tố phi kim không có ánh kim, dẫn điện, dẫn nhiệt kém; Nhiệt độ nóng chảy thấp. - Một số phi kim độc như: Cl2, Br2, I2.
b) Tính chất hóa học:
- Tác dụng với kim loại: Phản ứng thường xảy ra ở nhiệt độ cao
+ T/d với oxi → (to) oxit
VD: 3Fe + 2O2 → (to) Fe3O4
+ Tác dụng với phi kim khác (Cl2, S, …) → muối
VD: 2Na + Cl2 → (to) 2NaCl
- Tác dụng với phi kim khác
VD: H2 + Cl2 → (to) 2HCl
S + O2 → (to) SO2
I – MỐI QUAN HỆ GIỮA CÁC LOẠI HỢP CHẤT VÔ CƠ
II CÁC LOẠI HỢP CHẤT VÔ CƠ:
1. OXIT
a) Định nghĩa: Oxit là hợp chất gồm 2 nguyên tố, trong đó có một nguyên tố là oxi.
Vd: CaO, SO2, CO, Na2O, Fe3O4, P2O5, …
b) Tính chất hóa học
Tính chất hóa học | Oxit axit | Oxit bazơ |
1. Tác dụng với nước | Một số oxit + H2O → dd axit (SO2, CO2, P2O5,…) VD: CO2 + H2O → H3PO4 | Một số oxit + H2O → dd bazơ (Na2O, BaO, CaO, K2O,…) VD: Na2O + H2O → 2NaOH * Các oxit bazơ như: MgO, CuO, Al2O3, FeO, … không tác dụng với nước. |
2. Tác dụng với axit | Không phản ứng | Oxit bazơ + axit muối + nước |
3. Tác dụng với dung dịch bazơ | Oxit axit + dd bazơ →muối + nước - SO2 + Ca(OH)2 → CaSO3 + H2O CO2 + Ba(OH)2 → BaCO3 + H2O | Không phản ứng |
4. Tác dụng với oxit axit | Không phản ứng | Oxit bazo + oxit axit → muối Na2O + CO2 → Na2CO3 |
5. Tác dụng với oxit bazơ | Oxit axit + oxit bazơ → Muối SO2 + BaO → BaSO3 | Không phản ứng |
a) Định nghĩa: Axit là hợp chất mà phân tử gồm có một hay nhiều nguyên tử H liên kết với gốc axit. Các nguyên tử H này có thể thay thế bằng các ng/tử kim loại.
Vd: HCl, HNO3, H2SO4, H3PO4, …
b) Tính chất hóa học:
- Làm đổi màu chất chỉ thị: Quì tím hóa đỏ
- Tác dụng với kim loại (trước H trong dãy hoạt động hóa học)
Fe + 2HCl → FeCl2 + H2
Cu + HCl → (không phản ứng)
Lưu ý: HNO3 và H2SO4 đặc nóng tác dụng với hầu hết các kim loại (trừ Au, Pt), sản phẩm phản ứng không giải phóng H2.
Al, Fe, Cr bị thụ động hóa trong HNO3 và H2SO4 đặc nguội.
- Tác dụng với oxit bazơ
CuO + 2HCl → CuCl2 + H2O
- Tác dụng với bazơ
NaOH + HCl → NaCl + H2O
- Tác dụng với dung dịch muối
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
Điều kiện phản ứng: Có chất không tan hoặc chất khí tạo thành.
3. BAZƠ
a) Định nghĩa: Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (OH).
Vd: KOH, NaOH, Ba(OH)2, Al(OH)3, …
b) Tính chất hóa học:
- Đổi màu chất chỉ thị, cụ thể:
+ Quì tím hóa xanh
+ Phenolphtalein hóa hồng
- Tác dụng với axit
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
- Tác dụng với oxit axit
Na2O + CO2 → Na2CO3
- Tác dụng với dung dịch muối
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
KOH + NaCl → không phản ứng
Điều kiện: Có chất kết tủa hoặc chất khí tạo thành sau phản ứng.
- Phản ứng nhiệt phân
Fe(OH)3 →(to) Fe2O3 + 3H2O
4. MUỐI
a) Định nghĩa: Muối là hợp chất mà phân tử có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit. Vd: NaCl, MgSO4, Fe(NO3)2, BaCO3, …
b) Tính chất hóa học:
- Tác dụng với kim loại → muối mới + kim loại mới
Fe + CuSO4 → FeSO4 + Cu
Lưu ý: Chỉ kim loại đứng trước (trừ Na, K, Ba, Ca) mới đẩy được KL đứng sau ra khỏi dung
- Tác dụng với axit → muối mới + axit mới
NaHCO3 + HCl → NaCl + CO2↑ + H2O
Đk: có chất khí hoặc kết tủa tạo thành
- Tác dụng với dung dịch bazơ → muối mới + bazơ mới
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Đk: Có chất kết tủa hoặc chất khí tạo thành.
- Tác dụng với muối → muối mới + muối mới
AgNO3 + NaCl →AgCl↓ + NaNO3
NaHCO3 + NaHSO4 → Na2SO4 + CO2 + H2O
· PHẢN ỨNG TRUNG HÒA
Phản ứng giữa axít và bazơ được gọi là phản ứng trung hòa, sản phẩm của phản ứng này là muối và nước
· PHẢN ỨNG TRAO ĐỔI
- Định nghĩa: Là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
Vd: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
NaCl + AgNO3 → AgCl↓ + NaNO3
III – KIM LOẠI:
1. TÍNH CHẤT CHUNG CỦA KIM LOẠI
2. a) Tính chất vật lý:
- Có tính dẻo, dễ dát mỏng và dễ kéo sợi.
- Dẫn điện và dẫn nhiệt tốt. (Ag là kim loại dẫn điện và dẫn nhiệt tốt nhất, tiếp theo là Cu, Al, Fe, …)
- Có ánh kim.
b) Tính chất hóa học:
- Tác dụng với phi kim: Phản ứng thường xảy ra ở nhiệt độ cao
+ T/d với oxi → (to) oxit
VD: 3Fe + 2O2 → (to) Fe3O4
+ Tác dụng với phi kim khác (Cl2, S, …) → muối
VD: 2Na + Cl2 → (to) 2NaCl
- Tác dụng với dung dịch axit → muối + H2
VD: Fe + 2HCl → FeCl2 + H2
Lưu ý: KL đứng trước H trong dãy hoạt động hóa học
- Tác dụng với nước → dd bazơ (Lưu ý: chỉ có một số KL như Na, K, Ba, Ca)
VD: 2Na + H2O → 2NaOH
- Tác dụng với muối → Muối mới + KL mới
VD: Fe + CuSO4 → FeSO4 + Cu
Lưu ý: Chỉ kim loại đứng trước (trừ Na, K, Ba, Ca) mới đẩy được KL đứng sau ra khỏi dung dịch muối
· DÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI
V – PHI KIM:
1. TÍNH CHẤT CHUNG CỦA PHI KIM a) Tính chất vật lý:
Ở điều kiện thường, phi kim tồn tại ở cả 3 trạng thái: rắn (S, P, ...) ; lỏng (Br2) ; khí (Cl2, O2, N2, H2, ...). - Phần lớn các nguyên tố phi kim không có ánh kim, dẫn điện, dẫn nhiệt kém; Nhiệt độ nóng chảy thấp. - Một số phi kim độc như: Cl2, Br2, I2.
b) Tính chất hóa học:
- Tác dụng với kim loại: Phản ứng thường xảy ra ở nhiệt độ cao
+ T/d với oxi → (to) oxit
VD: 3Fe + 2O2 → (to) Fe3O4
+ Tác dụng với phi kim khác (Cl2, S, …) → muối
VD: 2Na + Cl2 → (to) 2NaCl
- Tác dụng với phi kim khác
VD: H2 + Cl2 → (to) 2HCl
S + O2 → (to) SO2

