 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Hạt nhân nguyên tử, nguyên tố hóa học, cấu hình electron nguyên tử
I. Hạt nhân nguyên tử
1/ Điện tích hạt nhân
Điện tích hạt nhân chính là tổng điện tích của proton.
Z = số proton = số electron = E (Nguyên tử trung hòa về điện)
Ví dụ: Nguyên tử Na có: Z =13 => Nguyên tử Na có 13 proton và 13 electron.
2/ Số khối
Số khối của hạt nhân bằng tổng số proton (Z) với tổng số nơtron (N).
A = Z + N
Ví dụ: Hạt nhân nguyên tử Nhôm có 13 proton và 14 notron.
⇒ Số khối A = 13 + 14 = 27
II. Nguyên tố hóa học
1/ Định nghĩa
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
- Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
2/ Số hiệu nguyên tử
- Là số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố.
- Số hiệu nguyên tử cho biết:
+ Số proton trong hạt nhân nguyên tử
+ Số electron trong nguyên tử
+ Từ đó cũng xác định được số notron trong nguyên tử
Z = số proton = số electron = E (Nguyên tử trung hòa về điện)
N = A – Z (A là số khối, Z là số hiệu nguyên tử)
3/ Kí hiệu nguyên tử của nguyên tố X.
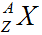
Trong đó:
A: Số khối
Z: Số hiệu nguyên tử
X: Kí hiệu hóa học của nguyên tố
Ví dụ: (16/8)O ⇒ nguyên tử Oxi có số khối A = 16 và số hiệu nguyên tử Z = 8
III. Cấu hình electron nguyên tử
1. Thứ tự các mức năng lượng trong nguyên tử
Các nguyên lý và quy tắc phân bố electron trong nguyên tử
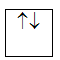
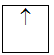
a/ Nguyên lý Pauli: Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
1 obitan có 2e: 2e
1 obitan có 1e: 1e
b/ Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.
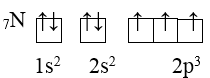
c/ Quy tắc Hund: Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau.
Ví dụ:
d/ Trật tự các mức năng lượng nguyên tử: Trong nguyên tử, các electron trên các obitan khác nhau, nhưng cùng 1 phân lớp có mức năng lượng như nhau. Các mức năng lượng nguyên tử tăng dần theo trình tự:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
2. Cấu hình electron nguyên tử
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp của các lớp electron khác nhau.
a/ Cách viết cấu hình electron nguyên tử
- Xác định số electron trong nguyên tử.
- Phân bố các electron theo trật tự mức năng lượng AO tăng dần.
- Viết cấu hình electron theo thứ tự các phân lớp electron trong một lớp.
Ví dụ: 26Fe. Viết theo trật tự mức năng lượng AO tăng dần:
1s2-2s2-2p6-3s2-3p6-4s2-3d6
- Sau đó viết lại theo thứ tự các phân lớp electron trong 1 lớp:
1s2-2s2-2p6-3s2-3p6-3d6-4s2
- Viết gọn: [Ar] 3d6-4s2
* Chú ý: Khi viết cấu hình electron để dễ nhớ trật tự các mức năng lượng, ta viết theo thứ tự lớp với 2 phân lớp s, p như sau:
1s 2s2p 3s3p 4s ... 4p 5s ... 5p 6s ... 6p 7s ... 7p
- Sau đó thêm 3d vào giữa lớp 4s ... 4p
- Thêm 4d vào giữa lớp 5s ... 5p
- Thêm 4f 5d vào giữa lớp 6s ... 6p
- Thêm 5f 6d vào giữa lớp 7s ... 7p
- Ta sẽ được: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
b/ Đặc điểm của lớp electron ngoài cùng
- Các electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố.
- Số electron lớp ngoài cùng tối đa là 8e
+ Các nguyên tử kim loại có: 1e, 2e, 3e lớp ngoài cùng.
+ Các nguyên tử phi kim có: 5e, 6e, 7e lớp ngoài cùng.
+ Các nguyên tử khí hiếm có: 8e (He có 2e) lớp ngoài cùng.
+ Các nguyên tử có 4e lớp ngoài cùng có thể là kim loại (Ge, Sn, Pb) có thể là phi kim (C, Si).

