 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Lý thuyết: Các loại liên kết hóa học
- Trong hóa học,liên kết hóa học là lực, giữ cho các nguyên tử cùng nhau trong các phân tử hay các tinh thể. Sự hình thành các liên kết hóa học giữa các nguyên tố để tạo nên phân tử được hệ thống hóa thành các lý thuyết liên kết hóa học.
- Thuyết liên kết hóa trị và khái niệm của số ôxi hóa được dùng để dự đoán cấu trúc và thành phần phân tử.
- Thuyết vật lý cổ điển về liên kết điện tích và khái niệm của số điện âm dùng để dự đoán nhiều cấu trúc ion.Với các hợp chất phức tạp hơn, chẳng hạn các phức chất kim loại, thuyết liên kết hóa trị không thể giải thích được và sự giải thích hoàn hảo hơn phải dựa trên các cơ sở của cơ học lượng tử.
Các đặc trưng không gian và khoảng năng lượng tương tác bởi các lực hóa học nối với nhau thành một sự liên tục, vì thế các thuật ngữ cho các dạng liên kết hóa học khác nhau là rất tương đối và ranh giới giữa chúng là không rõ ràng. Tuy vậy, Mọi liên kết hóa học đều nằm trong những dạng liên kết hóa học được đề cập dưới đây.
I/ Sự tạo thành liên kết ion, anion, cation
a/ Sự tạo thành ion:
- Trong phản ứng hóa học, khi nguyên tử, phân tử thêm hoặc mất bớt electron nó sẽ tạo thành các phần tử mang điện được gọi là ion. Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo thành hợp chất chứa liên kết ion.
- Điều kiện hình thành liên kết ion:
+ Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1,7 là liên kết ion (trừ một số trường hợp).
- Dấu hiệu cho thấy phân tử có liên kết ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
Ví dụ: Các phân tử NaCl, MgCl2, BaF2,…đều chứa liên kết ion, là liên kết được hình thành giữa các cation kim loại và anion phi kim.
+ Phân tử hợp chất muối chứa cation hoặc anion đa nguyên tử.
Ví dụ: Các phân tử NH4Cl, MgSO4, AgNO3,… đều chứa liên kết ion, là liên kết được hình thành giữa cation kim loại hoặc amoni và anion gốc axit.
Đặc điểm của hợp chất ion: Các hợp chấy ion có nhiệt độ nóng chảy và nhiệt độ sôi cao, dẫn điện khi tan tròn nước hoặc nóng chảy.
- Ion được chia thành cation và anion:
Cation : Ion dương
Anion : Ion âm
b/ Sự tạo thành cation
- Ion mang điện tích dương gọi là ion dương hay cation.
- Nếu các nguyên tử nhường bớt electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
Ví dụ : Sự hình thành Cation của nguyên tử Li (Z=3)
Cấu hình e: 1s2-2s1
1s2-2s1 → 1s2 + 1e
hay: Li → Li+ + 1e
Li+ gọi là cation liti
b) Sự tạo thành anion
- Ion mang điện tích âm gọi là ion âm hay anion.
- Nếu các nguyên tử nhận thêm electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích âm hay còn gọi là anion.
Ví dụ : Sự hình thành anion của nguyên tử F(Z=9)
Cấu hình e: 1s2-2s2-2p5
1s2-2s2-2p5 + 1 e → 1s2-2s2-2p6
Hay: F + 1e → F-
F - gọi là anion florua
d/ Ion đơn nguyên tử và ion âm đa nguyên tử
- Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử . Thí dụ cation Li+ , Na+, Mg(2+), Al(3+) và anion F -, Cl-, S(2-) , …….
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm . Thí dụ : cation amoni NH4+, anion hidroxit OH-, anion sunfat SO4(2–), …
II/ Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Điều kiện hình thành liên kết cộng hóa trị:
Các nguyên tử giống nhau hoặc gần giống nhau, liên kết với nhau bằng cách góp chung các electron hóa trị.
Ví dụ: Cl2, H2, N2, HCl, H2O…
- Dấu hiệu cho thấy phân tử có liên kết cộng hóa trị:
+ Phân tử đơn chất được hình thành từ phi kim.
Ví dụ: Các phân tử O2 , F2 ,H2,N2… đều chứa liên kết cộng hóa trị, là liên kết được hình thành giữa hai nguyên tử phi kim giống nhau.
+ Phân tử hợp chất được hình thành từ các phi kim.
Ví dụ: Các phân tử F2O,HF,H2O,NH3,CO2… đều chứa liên kết hóa trị, là liên kết được hình thành giữa hai nguyên tử phi kim khác nhau.
- Liên kết cộng hóa trị được chia thành 2 loại :
+ Liên kết công hóa trị có cực: Khi cặp liên electron dùng chung phân bố đối xứng giữa hai hạt nhân nguyên tử than gia liên kết thì đó là liên kết hóa trị không phân cực.
+ Liên kết cộng hóa trị không cực: Khi cặp electron dùng chung bị hút lệch về nguyền tử có độ âm điện lớn hơn thì đó là liên kết cộng hóa trị có cực.
* Chú ý
- Liên kết cộng hóa trị không phân cực 0,0 <= Δλ < 0,4
- Liên kết cộng hóa trị phân cực: 0,4 <= Δλ < 1,7
- Liên kết ion: Δλ ≥ 1,7
- Liên kết cho – nhận:. là trường hợp đặc biệt của liên kết cộng hóa trị khi cặp electron dùng chung chỉ do một nguyên tử đóng góp. Nguyên tử đóng góp cặp electron là nguyên tử cho, nguyên tử nhận cặp electron gọi là nguyên tử nhân. Liên kết cho – nhận biển diễn bằng mũi tên “ → ”, gốc mũi tên là nguyên tử cho, đầu mũi tên là nguyên tử nhận.
- Điều kiện hình thành liên kết cho – nhận: Nguyên tử cho phải có cặp electron chưa tham gia liên kết, nguyện tử nhận phải có obitan trống (hoặc dồn hai electron độc thân lại để tạo ra obitan trống).
III/ Liên kết kim loại
- Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
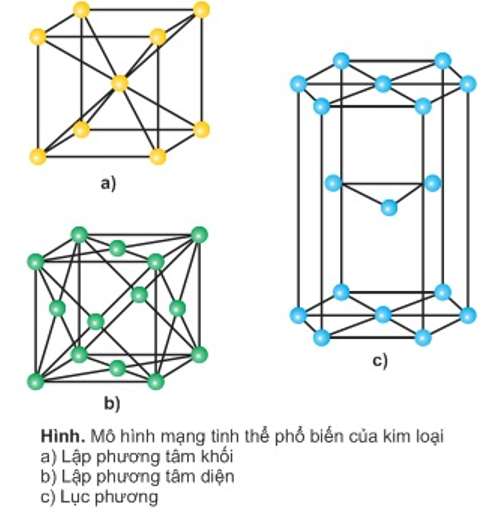
- Mạng tinh thể kim loại: tồn tại 3 dạng phổ biến
+ Lập phương tâm khối: các nguyên tử, ion kim loại nằm trên các đỉnh vá tâm của hình lập phương.
+ Lập phương tâm diện: các nguyên tử, ion kim loại nằm trên acsc đỉnh và tâm các mặt của hình lập phương.
+ Lục phương: các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và 3 nguyên tử, ion nằm phía trong của hình lục giác.
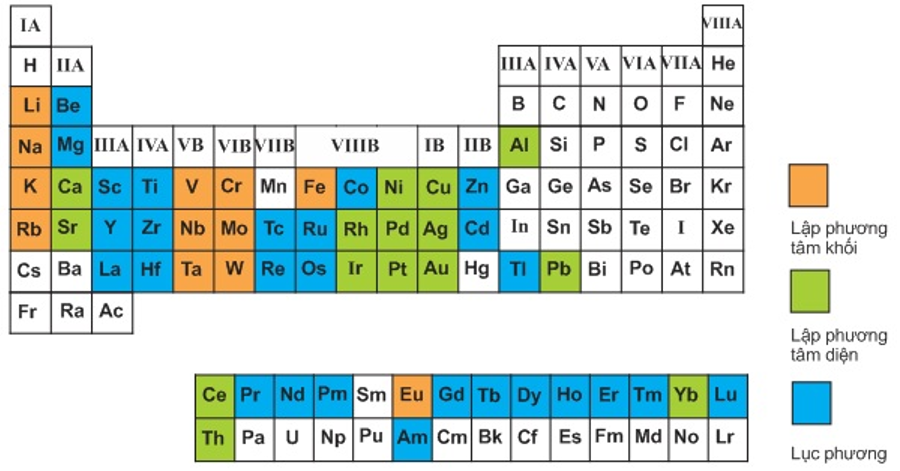
Bảng 3.1
Kiểu cấu trúc mạng tinh thể phổ biến của một số kim loại trong bảng tuần hoàn
- Tính chất của tinh thể kim loại: Có ánh kim, dẫn điện, dẫn nhiệt tốt và có tính dẻo.
- Trong hóa học,liên kết hóa học là lực, giữ cho các nguyên tử cùng nhau trong các phân tử hay các tinh thể. Sự hình thành các liên kết hóa học giữa các nguyên tố để tạo nên phân tử được hệ thống hóa thành các lý thuyết liên kết hóa học.
- Thuyết liên kết hóa trị và khái niệm của số ôxi hóa được dùng để dự đoán cấu trúc và thành phần phân tử.
- Thuyết vật lý cổ điển về liên kết điện tích và khái niệm của số điện âm dùng để dự đoán nhiều cấu trúc ion.Với các hợp chất phức tạp hơn, chẳng hạn các phức chất kim loại, thuyết liên kết hóa trị không thể giải thích được và sự giải thích hoàn hảo hơn phải dựa trên các cơ sở của cơ học lượng tử.
Các đặc trưng không gian và khoảng năng lượng tương tác bởi các lực hóa học nối với nhau thành một sự liên tục, vì thế các thuật ngữ cho các dạng liên kết hóa học khác nhau là rất tương đối và ranh giới giữa chúng là không rõ ràng. Tuy vậy, Mọi liên kết hóa học đều nằm trong những dạng liên kết hóa học được đề cập dưới đây.
I/ Sự tạo thành liên kết ion, anion, cation
a/ Sự tạo thành ion:
- Trong phản ứng hóa học, khi nguyên tử, phân tử thêm hoặc mất bớt electron nó sẽ tạo thành các phần tử mang điện được gọi là ion. Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo thành hợp chất chứa liên kết ion.
- Điều kiện hình thành liên kết ion:
+ Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1,7 là liên kết ion (trừ một số trường hợp).
- Dấu hiệu cho thấy phân tử có liên kết ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
Ví dụ: Các phân tử NaCl, MgCl2, BaF2,…đều chứa liên kết ion, là liên kết được hình thành giữa các cation kim loại và anion phi kim.
+ Phân tử hợp chất muối chứa cation hoặc anion đa nguyên tử.
Ví dụ: Các phân tử NH4Cl, MgSO4, AgNO3,… đều chứa liên kết ion, là liên kết được hình thành giữa cation kim loại hoặc amoni và anion gốc axit.
Đặc điểm của hợp chất ion: Các hợp chấy ion có nhiệt độ nóng chảy và nhiệt độ sôi cao, dẫn điện khi tan tròn nước hoặc nóng chảy.
- Ion được chia thành cation và anion:
Cation : Ion dương
Anion : Ion âm
b/ Sự tạo thành cation
- Ion mang điện tích dương gọi là ion dương hay cation.
- Nếu các nguyên tử nhường bớt electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
Ví dụ : Sự hình thành Cation của nguyên tử Li (Z=3)
Cấu hình e: 1s2-2s1
1s2-2s1 → 1s2 + 1e
hay: Li → Li+ + 1e
Li+ gọi là cation liti
b) Sự tạo thành anion
- Ion mang điện tích âm gọi là ion âm hay anion.
- Nếu các nguyên tử nhận thêm electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích âm hay còn gọi là anion.
Ví dụ : Sự hình thành anion của nguyên tử F(Z=9)
Cấu hình e: 1s2-2s2-2p5
1s2-2s2-2p5 + 1 e → 1s2-2s2-2p6
Hay: F + 1e → F-
F - gọi là anion florua
d/ Ion đơn nguyên tử và ion âm đa nguyên tử
- Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử . Thí dụ cation Li+ , Na+, Mg(2+), Al(3+) và anion F -, Cl-, S(2-) , …….
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm . Thí dụ : cation amoni NH4+, anion hidroxit OH-, anion sunfat SO4(2–), …
II/ Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Điều kiện hình thành liên kết cộng hóa trị:
Các nguyên tử giống nhau hoặc gần giống nhau, liên kết với nhau bằng cách góp chung các electron hóa trị.
Ví dụ: Cl2, H2, N2, HCl, H2O…
- Dấu hiệu cho thấy phân tử có liên kết cộng hóa trị:
+ Phân tử đơn chất được hình thành từ phi kim.
Ví dụ: Các phân tử O2 , F2 ,H2,N2… đều chứa liên kết cộng hóa trị, là liên kết được hình thành giữa hai nguyên tử phi kim giống nhau.
+ Phân tử hợp chất được hình thành từ các phi kim.
Ví dụ: Các phân tử F2O,HF,H2O,NH3,CO2… đều chứa liên kết hóa trị, là liên kết được hình thành giữa hai nguyên tử phi kim khác nhau.
- Liên kết cộng hóa trị được chia thành 2 loại :
+ Liên kết công hóa trị có cực: Khi cặp liên electron dùng chung phân bố đối xứng giữa hai hạt nhân nguyên tử than gia liên kết thì đó là liên kết hóa trị không phân cực.
+ Liên kết cộng hóa trị không cực: Khi cặp electron dùng chung bị hút lệch về nguyền tử có độ âm điện lớn hơn thì đó là liên kết cộng hóa trị có cực.
* Chú ý
- Liên kết cộng hóa trị không phân cực 0,0 <= Δλ < 0,4
- Liên kết cộng hóa trị phân cực: 0,4 <= Δλ < 1,7
- Liên kết ion: Δλ ≥ 1,7
- Liên kết cho – nhận:. là trường hợp đặc biệt của liên kết cộng hóa trị khi cặp electron dùng chung chỉ do một nguyên tử đóng góp. Nguyên tử đóng góp cặp electron là nguyên tử cho, nguyên tử nhận cặp electron gọi là nguyên tử nhân. Liên kết cho – nhận biển diễn bằng mũi tên “ → ”, gốc mũi tên là nguyên tử cho, đầu mũi tên là nguyên tử nhận.
- Điều kiện hình thành liên kết cho – nhận: Nguyên tử cho phải có cặp electron chưa tham gia liên kết, nguyện tử nhận phải có obitan trống (hoặc dồn hai electron độc thân lại để tạo ra obitan trống).
III/ Liên kết kim loại
- Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
- Mạng tinh thể kim loại: tồn tại 3 dạng phổ biến
+ Lập phương tâm khối: các nguyên tử, ion kim loại nằm trên các đỉnh vá tâm của hình lập phương.
+ Lập phương tâm diện: các nguyên tử, ion kim loại nằm trên acsc đỉnh và tâm các mặt của hình lập phương.
+ Lục phương: các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và 3 nguyên tử, ion nằm phía trong của hình lục giác.

Bảng 3.1
Kiểu cấu trúc mạng tinh thể phổ biến của một số kim loại trong bảng tuần hoàn

- Tính chất của tinh thể kim loại: Có ánh kim, dẫn điện, dẫn nhiệt tốt và có tính dẻo.

