Các orbital hóa trị của nguyên tử được cấu tạo bởi các suborbital (s và p). Suborbital s có dạng hình cầu và có thể chứa 2 điện tử (một có spin up và một có spin down). Còn suborbital p có dạng hình số 8 nổi sắp xếp dọc theo trục x, y & z và chứa tổng cộng 6 electron (2 trên mỗi trục, 3 với spin up và 3 với spin down) . Vì nguyên tử thỏa mãn về mặt năng lượng khi tất cả các electron đều được ghép đôi và 2 + 6 = 8 nên nguyên tử phải có 8 electron ở lớp vỏ hóa trị của nó để ghép đôi được tất cả các electron.
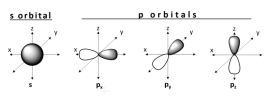
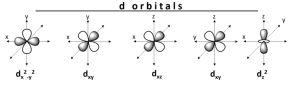
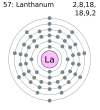
Tuy nhiên, quy tắc bát tử lại không áp dụng cho tất cả các nguyên tử, đối với các kim loại chuyển tiếp và các nguyên tố phía sau, 1 suborbital d có thể chứa thêm 10 điện tử, có nghĩa là bây giờ một nguyên tử có thể có 18 điện tử trong lớp vỏ hóa trị của nó (VD: Lantan chẳng hạn, xem hình dưới đây).
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.




