Oxi dồn e lại tạo AO trống để nhận cặp e.... Cái này chị chưa chắc chắn đúng nhưng thấy hợp lý, xem như chấp nhận. Theo cách giải thích của em thì em viết không sai.
Nhưng có 1 chỗ chị muốn hỏi cho rõ, em bảo "Cách 2: Áp dụng cho
tất cả trường hợp" là như thế nào? Như chị nghĩ thì ý em là quy tắc Octed đúng cho mọi trường hợp, không biết phải không???
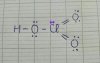
HNO3 nếu bảo viết ct lewis thì chị viết như sau
View attachment 87014
Còn bảo giải thích sự hình thành liên kết thì chị sẽ dùng thuyết lai hóa để giải thích. Và lk π chỗ nối đôi đó không định chỗ, nghĩa là nó chạy qua lại giữa 2 lk N-O (giống lk π của vòng benzen)
Giải thích:
View attachment 87017
Nitơ sử dụng 1 AO chứa điện tử tự do lk với AO chứa điện tử tự do của 1 nguyên tử Oxi hình thành 1 lk [tex]\sigma[/tex] (chỗ H-O-N....)
Nitơ tổ hợp 1 AO-s với 2 AO-p tạo 3 AO lai hóa sp2.
2 AO lai hóa xen phủ trục với 2 AO chứa 2 điện tử tự do của 2 nguyên tử oxi tạo 2 lk [tex]\sigma[/tex] với 2 O. AO lai hóa còn lại xen phủ bên với AO chứa điện tử tự do còn lại của 1 trong 2 nguyên tử O trên tạo liên kết π. Do tính chất đối xứng nên không thể xác định rõ lk π đó được hình thành với oxi nào nên nó là lk π không định chỗ.
Bậc liên kết của nitơ trong HNO3 là 4/3 ~ 1,33
1 nguyên tố muốn cho cặp e thì nó phải có cặp e hóa trị có thể cho được
1 nguyên tố muốn nhận cặp e thì nó phải có orbital hóa trị trống để nhận
Nguyên tố chu kỳ 2 muốn có lk cho nhận thì cấu hình e lớp ngoài cùng của nó hoặc có cặp e để cho hoặc có AO trống để nhận. Ví dụ: Bo
View attachment 87020
có 2 AO trống, 1 cặp e => có thể hình thành được 2 lk cho nhận kiểu nhận, 1 lk cho nhận kiểu cho. Tương tự các nguyên tố khác thuộc chu kỳ 2 đều có thể cho cặp e
Cũng có thể như em nói, nó dồn về cùng AO để tạo AO trống (!)
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.