- 13 Tháng chín 2017
- 2,335
- 4,740
- 584
- Nghệ An
- .
 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
NHÔM VÀ HỢP CHẤT CỦA NHÔM
A/ Lý thuyết Nhôm và hợp chất của NhômI. Nhôm
1.Vị trí trong bảng tuần hoàn, cấu hình electron:
a, Vị trí:
Nằm ô thứ 13 (Z=13), nhóm IIIA, chu kì 3 trong bảng tuần hoàn.
b,Cấu hình electron:
[imath][Ne]3s^23p^1[/imath], nguyên tố nhóm p, 3e lớp ngoài cùng.
2. Tính chất vật lý
- Là kim loại màu trắng bạc, mềm, dễ dát mỏng, kéo sợi. Có nhiệt độ nóng chảy là [imath]660^oC[/imath]
-Là kim loại nhẹ [imath](2,7g/cm^3)[/imath], dẫn điện tốt (gấp 3 lần sắt)
3.Tính chất hóa học:
Nhôm có tính khử mạnh, chỉ sau kim loại kiềm và kiềm thổ nên dễ bị oxh thành ion dương.
a,Tác dụng với phi kim [imath]\to[/imath] Muối or oxit
b, Tác dụng với acid
- Acid không có tính oxh [imath]\to[/imath] muối + [imath]H_2[/imath]
- Acid có tính oxh [imath]\to[/imath] muối [imath]+H_2O+[/imath] chất khử
VD: [imath]Al+4HNO_3(l) \to Al(NO_3)_3+NO+2H_2O[/imath]
[imath]Al+H_2SO_4(đặc,nguội)\to[/imath] không phản ứng.
c, Tác dụng với oxit kim loại (phản ứng nhiệt nhôm)
Ở nhiệt độ cao, Nhôm có thể khử nhiều oxit của kim loại (đứng sau Zn) tạo thành nhôm oxit và kim loại đó (hoặc oxit thấp hơn của kim loại đó)
VD: [imath]2Al+3CuO \to Al_2O_3+3Cu[/imath] (điều kiện nhiệt độ)
d, Tác dụng với nước.
Al có khả năng phản ứng với nước tại nhiệt độ thường, tuy nhiên phản ứng xảy ra rất nhanh đã bị ngừng lại do có lớp [imath]Al(OH)_3[/imath] bám bên ngoài ngăn cách.
Phản ứng: [imath]2Al+6H_2O\to 2Al(OH)_3+ 3H_2[/imath]
e, Tác dụng với dung dịch kiềm:
Vì bao bọc ngoài nhôm thường có lớp oxit [imath]Al_2O_3[/imath] nên khi cho thanh nhôm vào dung dịch kiềm thì thứ tự phản ứng sẽ là:
VD (NaOH)
[imath]Al_2O_3+ 2NaOH \to 2NaAlO_2+H_2O[/imath]
[imath]2Al+6H_2O\to 2Al(OH)_3+3H_2[/imath]
[imath]Al(OH)_3+NaOH \to NaAlO_2+ 2H_2O[/imath]
Và phản ứng tổng khi cho Al (tinh khiết) vào kiềm là
[imath]nAl(OH)_3+M(OH)_n\to M(AlO_2)_n+2nH_2O[/imath]
p/s: Có thể viết [imath][AlO_2^-][/imath] là [imath][Al(OH)_4^-][/imath]
f, Tác dụng với dung dịch muối.
Nhôm có thể phản ứng với muối của gốc kim loại yếu hơn nó và tạo thành muối của nhôm với chính kim loại đó.
VD: [imath]2Al+ 3CuCl_2\to 2AlCl_3+3Cu[/imath]
4. Ứng dụng, trạng thái tồn tại và sản xuất
a, Ứng Dụng : ( Ứng dụng của nhôm và hợp kim của Nhôm)
- Nhẹ, bền với không khí và nước : dùng làm nhiên liệu chế tạo máy bay, tên lửa.
- Có màu trắng bạc, đẹp: dùng trong xây dựng nhà cửa và trang trí nội thất.
- Nhẹ, dẫn điện tốt: thay thế đồng làm dây dẫn điện
- Dẫn nhiệt tốt, không độc, ít bị gỉ: dùng trong nhà bếp
- Tecmit ( Al và [imath]Fe_2O_3[/imath]): dùng làm đường ray tàu hỏa.
- Trong quả đất, Nhôm chiếm khoảng 5,5 số lượng nguyên tử.
- Nhôm không tồn tại ở dạng đơn chất (do hoạt động mạnh) mà tồn tại ở dạng hợp chất như:
- Đất sét: [imath]Al_2O_3.2SiO_2.2H_2O[/imath]
- Mica: [imath]K_2O.Al_2O_3.6SiO_2[/imath]
- Boxit: [imath]Al2O_3.xH_2O[/imath]
- Criolit: [imath]Na_3[AlF_6][/imath]
Nguyên liệu chính: Quặng boxit và Criolit.
Sản xuất nhôm gồm 3 giai đoạn chính:
Giai đoạn 1: Làm sạch quặng boxit lẫn [imath]Fe_2O_3.SiO_2[/imath]
- Cho quặng vào dung dịch [imath]NaOH[/imath] dư [imath]\to SiO_2, Al_2O_3[/imath] tan,lọc bỏ [imath]Fe_2O_3[/imath]
- Sục [imath]CO_2[/imath] vào, lọc kết tủa [imath]\to Al(OH)_3[/imath]
- Đem kết tủa nung nóng thu được [imath]Al_2O_3[/imath]
Giai đoạn 3: Điện phân nóng chảy [imath]Al_2O3[/imath] thu được [imath]Al[/imath] tinh khiết.
II, Các hợp chất quan trọng của nhôm
1.[imath]Al_2O_3[/imath]
a, Tính chất vật lý:
Chất rắn màu trắng, không tan trong nước, cứng, chịu nhiệt tốt (nhiệt độ nóng chảy cao ~ [imath]2050^oC[/imath])
b, Tính chất hóa học:
- Là oxit lưỡng tính (phản ứng được với acid và dung dịch kiềm)
- Không bị khử bởi [imath]CO,H_2[/imath]
2.[imath]Al(OH)_3[/imath]
a, Tính chất vật lý: Chất keo màu trắng, không tan trong nước, kém bền nhiệt.
b, Tính chất hóa học:
- Là hidroxit lưỡng tính (phản ứng được với acid và dung dịch kiềm)
- Dễ bị phân hủy bởi nhiệt tạo [imath]Al_2O_3[/imath]
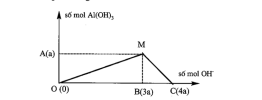
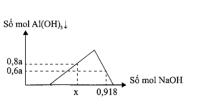
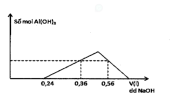
C1: Muối nhôm phản ứng với dung dịch kiềm
Lưu ý: Kiềm mạnh [imath]\to[/imath] vừa đủ, Kiềm yếu ([imath]NH_3,Na_2CO_3,..[/imath]) [imath]\to[/imath] cho dư.
C2: Muối gốc [imath]AlO_2^-[/imath] phản ứng với dung dịch aicd
Lưu ý: Acid mạnh [imath](HCl, H_2SO_4) \to[/imath] vừa đủ , acid yếu [imath](CO_2,..)\to[/imath] cho dư
3.Muối của Nhôm
a, [imath]Al_2(SO_4)_3[/imath]
- Là chất rắn màu trắng, bị nhiệt phân trên [imath]770^oC[/imath]
- Phèn nhôm (phèn chua: [imath]K_2SO_4.Al_2(SO_4)_3.24H_2O[/imath]) : tồn tại ở dạng tinh thể, không màu. Có vị hơi chua và chát, được dùng nhiều trong công nghiệp giấy, nhuộm và làm sạch nước.
Là muối của acid yếu, có thể phản ứng với acid mạnh hơn nó (VD: [imath]CO_2, HCl,…[/imath])