 [TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
[TẶNG BẠN] TRỌN BỘ Bí kíp học tốt 08 môn
 Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
Chắc suất Đại học top - Giữ chỗ ngay!!
ĐĂNG BÀI NGAY để cùng trao đổi với các thành viên siêu nhiệt tình & dễ thương trên diễn đàn.
DÃY ĐIỆN HÓA
Hôm nay , mình xin gửi cho các bạn chuyên đề : Dãy điện hóa
I. Cặp oxi hoá - khử của kim loạiHôm nay , mình xin gửi cho các bạn chuyên đề : Dãy điện hóa
- Nguyên tử kim loại dễ nhường electron trở thành ion kim loại, ngược lại ion kim loại có thể nhận electron trở thành nguyên tử kim loại.
VD : Ag+ + 1e -> Ag
- Các nguyên tử kim loại (Ag, Cu, Fe,...) đóng vai trò chất khử, các ion kim loại như Ag+, Cu(2+), Fe(2+) ... đóng vai trò chất oxi hoá.
- Chất oxi hoá và chất khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá - khử. Thí dụ ta có cặp oxi hoá - khử : Ag+/Ag ; Cu(2+)/Cu ; Fe(2+)/Fe.
Kết luận: Nói cặp oxi hóa khử là nói dạng oxi hóa trước dạng khử sau, và chúng ta ghi dạng oxi hóa trên dạng khử.
II. So sánh tính chất của các cặp oxi hoá - khử
VD : So sánh tính chất của hai cặp oxi hoá - khử Cu(2+)/Cu và Ag+/Ag, thực nghiệm cho thấy Cu tác dụng được với dung dịch muối Ag+ theo phương trình ion rút gọn :
Cu + 2Ag+ -> Cu(2+) + 2Ag
So sánh : Ion Cu(2+) không oxi hoá được Ag, trong khi đó Cu khử được ion Ag+. Như vậy, ion Cu(2+) có tính oxi hoá yếu hơn ion Ag+. Kim loại Cu có tính khử mạnh hơn Ag.
- Để so sánh cặp oxi hóa khử ta so sánh tính oxi hóa của dạng oxi hóa, tính khử của dạng khử. Mà chiều phản ứng oxi hóa khử là chất khử mạnh phản ứng với chất oxi hóa mạnh tạo chất khử và chất oxi hóa yếu hơn.
+ Tính oxi hóa: Cu(2+)< Ag+
+ Tính khử: Cu > Ag
III. Dãy điện hoá của kim loại
Người ta đã so sánh tính chất của nhiều cặp oxi hoá - khử và sắp xếp thành dãy điện hoá của kim loại :

Hình 1. Dãy điện hóa của kim loại
IV. Ý nghĩa của dãy điện hoá của kim loại
Ứng dụng 1: Xác định thứ tự ưu tiên Xác định thứ tự ưu tiên phản ứng của chất khử, của chất oxi hóa.
Lưu ý nếu có hỗn hơp nhiều chất oxi hóa khử tác dụng với nhau thì ta mới xét thứ tự ưu tiên.
Mạnh nhất phản ứng trước rồi mới đến các chất yếu hơn
Ứng dụng 2: Quy tắc α
Dãy điện hoá của kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hoá - khử theo quy tắc α (alpha) : Phản ứng giữa 2 cặp oxi hoá - khử sẽ xảy ra theo chiều, chất oxi hoá mạnh nhất sẽ oxi hoá chất khử mạnh nhất, sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.
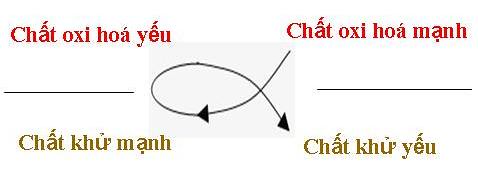
Hình 2. Quy tắc Alpha
------------------------------------------------------------------------------------------------------------------------------------------------------
Cảm ơn các bạn đã theo dõi bài viết


